题目内容
14.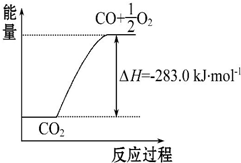 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
下列说法正确的是( )
| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |
分析 A、燃烧热是指可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成水为气态放热241.8kJ•mol-1;
B、依据热化学方程式①可知表示的意义是1mol一氧化氮和0,5mol氧气完全反应生成1mol二氧化碳放热283KJ;
C、图中未表示出物质的量和反应焓变的关系;
D、分解1mol水需要吸热,焓变为正值.
解答 解:A、热化学方程式中水不是稳定氧化物所以241.8kJ•mol-1不是氢气的燃烧热,故A错误;
B、热化学方程式①可知表示的意义是1mol一氧化氮和0,5mol氧气完全反应生成1mol二氧化碳放热283KJ,符合热化学方程式的含义,故B正确;
C、图中忽视化学计量数与反应热的定量关系,故C错误;
D、分解1mol水需要吸收241.8KJ的热量,故D错误;
故选B.
点评 本题考查了热化学方程式的分析应用,图象分析,热化学方程式的含义理解燃烧热概念应用,掌握基础是关键,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
4.下列各组物质性质比较中正确的是( )
| A. | 常温常压下溶解度:CaCO3<Na2CO3<NaHCO3 | |
| B. | 氧化性:Mg2+<H+<Cu2+<Fe3+ | |
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO | |
| D. | 沸点:SiC>I2>Si>HF |
5.下列物质中只有离子键的是( )
| A. | NaOH | B. | CaBr2 | C. | H2 | D. | H2S |
19.已知NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24L H2O含有的分子数为0.1NA | |
| B. | 标准状况下,2.24L H2 含有的分子数为0.1mol | |
| C. | 分子数为NA 的CO和N2混合气体的体积约为22.4L,质量为28g | |
| D. | 1mol CH4分子中所含的电子总数为10 NA |
6.下列物质既能发生消去反应,又能氧化成醛的是( )
| A. | 1-丙醇 | B. | 2,2-二甲基-1-丙醇 | ||
| C. | 2,2,2-三溴乙醇 | D. | 苯甲醇 |
3.下列叙述正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由于石墨转化为金刚石是吸热反应,所以金刚石比石墨稳定 | |
| C. | 在稀溶液中,强酸与强碱反应生成1molH2O将吸收57.3kJ热量 | |
| D. | 在101kPa时,2g氢气完全燃烧生成液态水放出285.8kJ热量,则等质量的氢气完全燃烧生成气态水时放出热量将小于285.8kJ |
4.可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是( )
| A. | 混合气通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气通过盛水的洗气瓶 | |
| C. | 混合气通过盛足量溴水的洗气瓶 | |
| D. | 混合气跟氯化氢混合 |