题目内容
10.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),流程如图: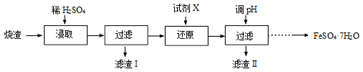
(1)浸取时,Al2O3与稀H2SO4反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(2)滤渣Ⅰ主要成分的化学式为SiO2,列举该物质的一种用途制造玻璃、光导纤维.
(3)还原时,试剂X可能是AB(填字母)
A.Fe粉 B.SO2 C.HNO3 D.KMnO4
(4)滤渣Ⅱ的主要成分是Al(OH)3(写化学式).
(5)由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
分析 烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入试剂X,起到还原剂的作用,X应为Fe、SO2等,得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O,以此解答该题.
解答 解:(1)Al2O3与稀H2SO4反应生成硫酸铝和水,反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)滤渣Ⅰ为二氧化硅,可用于制造玻璃、光导纤维等,故答案为:SiO2;制造玻璃、光导纤维;
(3)溶液中含有铁离子,加入还原剂生成亚铁离子,可为Fe、SO2等,故答案为:AB;
(4)由以上分析可知滤渣Ⅱ为氢氧化铝,即Al(OH)3,故答案为:Al(OH)3;
(5)溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O,故答案为:冷却结晶;过滤.
点评 本题考查化学实验制备方案设计,为高频考点,涉及盐类水解、氧化还原反应等知识点,明确反应原理及物质性质是解本题关键,熟悉流程图中发生的反应及基本操作方法,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
1.对某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ | |
| D. | 加入Na2CO3溶液产生白色沉淀,再加稀盐酸沉淀消失,一定有Ba2+ |
18.实验室里需用480mL0.1mol•L-1的硫酸铜溶液,以下操作正确的是( )
| A. | 称取7.68g硫酸铜,加入 480mL水 | B. | 称取12.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.5g胆矾配成500mL溶液 |
5.粗盐的提纯实验中,下列操作错误的是( )
| A. | 蒸发过程中用玻璃棒不断搅拌 | |
| B. | 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中 | |
| C. | 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干 | |
| D. | 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上 |
2.下列说法正确的是( )
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | 1molNaHSO4熔融态时有3mol离子 |
19.下列有关离子检验的操作、现象及结论均正确的是( )
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定不含K+ | |
| B. | 向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- | |
| C. | 向无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液中加入KSCN溶液无现象,再滴入少量H2O2,呈血红色,则该溶液中一定含有Fe2+ |
20.已知:H2(g)+I2(g)?2HI(g)的平衡常数为K1,$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数为K2,则K1和K2的关系为( )
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | K1=$\sqrt{{K}_{2}}$ |