题目内容
4.一定温度下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )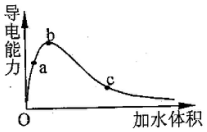
| A. | a,b,c三点溶液的pH:a>b>c | |
| B. | 若用湿润的pH试纸测试c处溶液的pH,比实际的pH偏小 | |
| C. | a,b,c三点溶液用1mol•L-1的NaOH溶液中和,消耗NaOH溶液的体积a>b>c | |
| D. | a,b,c点醋酸的电离程度:c>b>a |
分析 A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
B.用湿润的pH试纸测量酸性的pH,溶液稀释;
C.a、b、c三点溶液浓度不同,但溶质的物质的量相同;
D.随水的增多,醋酸的电离程度在增大.
解答 解:A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故A错误;
B.用湿润的pH试纸测量酸性的pH,a处溶液溶液稀释,导电能力增大,pH减小,所以测量结果偏小,故B错误;
C.a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,故C错误;
D.随水的增多,醋酸的电离程度在增大,所以a、b、c三点醋酸的电离程度:a<b<c,故D正确;
故选D.
点评 本题考查电解质的电离,题目难度中等,注意分析图象变化过程,把握弱电解质的电离特征,注意氢离子浓度越大,其溶液的pH越小.

练习册系列答案
相关题目
13.生活中碰到的某些问题,常常涉及到化学知识,下列分析正确的是( )
| A. | 氯气和二氧化硫均可做漂白剂,若同时使用它们漂白-湿润物质,漂白效果会更好 | |
| B. | 为消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质形式存在 | |
| C. | 工业酒精不能勾兑美酒,因其中含有甲醇,饮后会造成人的双目终生失明 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
15.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,以下说法错误的是( )
| A. | 放电时Cl-由负极向正极迁移 | |
| B. | 正极反应式为:AgCl+e-=Ag+Cl- | |
| C. | Mg作电池负极,发生氧化反应 | |
| D. | 当负极质量减轻4.8g,电路中通过0.4mol电子 |
12.下列说法正确的是( )
| A. | 燃料的燃烧都是放热反应 | |
| B. | 氯化钾的电子式为: | |
| C. | 决定化学反应速率的主要因素是反应物的浓度 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
19.常温下,下列物质能与NaOH水溶液发生反应的是( )
| A. | CH3COOH | B. | CH3CH2OH | C. | CH4 | D. | C6H12O6 |
6.2014年《RSC Advances》报道了一种全陶瓷固体氧化物铁-空气电池,工作原理如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 该电池常温下可稳定工作 | |
| B. | 放电时,电能转变为化学能 | |
| C. | 充电时,阳极发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 放电时,负极室发生反应:Fe+xH2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeOx+xH2,负极发生反应:H2+O2--2e-=H2O |
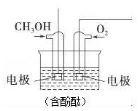 将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题: