题目内容
15.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,以下说法错误的是( )| A. | 放电时Cl-由负极向正极迁移 | |
| B. | 正极反应式为:AgCl+e-=Ag+Cl- | |
| C. | Mg作电池负极,发生氧化反应 | |
| D. | 当负极质量减轻4.8g,电路中通过0.4mol电子 |
分析 Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,所以金属Mg作负极,反应式为:Mg-2e-=Mg2+,正极反应为:2AgCl+2e-═2C1-+2Ag,阴离子移向负极,据此分析.
解答 解:A.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故A错误;
B.AgCl是难溶物,正极反应式为:AgCl+e-═C1-+Ag,故B正确;
C.活泼金属镁作负极,失电子发生氧化反应,故C正确;
D.活泼金属镁作负极,反应式为:Mg-2e-=Mg2+,则当负极质量减轻4.8g,电路中通过$\frac{4.8g}{24g/mol}$×2=0.4mol电子,故D正确;
故选:A.
点评 本题考查原电池工作原理,注意常见物质的性质,如镁的还原性以及银离子的氧化性是解题的关键,题目难度中等.

练习册系列答案
相关题目
4.W、X、Y、Z四种短周期主族元素,原子序数依次增大,四种元素的最外层电子数之和为17,W原子的最外层电子数为内层电子数的3倍,X是最活泼的非金属元素,Y是短周期中原子半径最大的元素.下列叙述不正确的是( )
| A. | 简单离子半径:W>X>Y>Z | |
| B. | 简单氢化物的稳定性:W<X | |
| C. | 最高价氧化物对应水化合物的碱性:Y>Z | |
| D. | Y的单质可以将Z从可溶性盐溶液中置换出来 |
3.下列有关能量变化的说法中不正确的是( )
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热取决于反应物和生成物具有的总能量的相对大小 | |
| C. | 可燃物燃烧和酸碱中和反应都是典型的放热反应 | |
| D. | 燃煤发电不需经过其它能量转换过程,可直接把化学能转化为电能 |
10.有机物6.4g完全燃烧消耗6.72L(标况)O2,生成4.48L(标况)CO2和一些水.该有机分子式为.
| A. | CH4 | B. | CH4O | C. | C2H4O | D. | C2H6O |
20.试分析有机物下列性质中该有机物不具有的是:( )

(1)加聚反应(2)加成反应 (3)使酸性高锰酸钾溶液褪色
(4)与NaHCO3溶液反应放出CO2气体 (5)与KOH溶液反应.

(1)加聚反应(2)加成反应 (3)使酸性高锰酸钾溶液褪色
(4)与NaHCO3溶液反应放出CO2气体 (5)与KOH溶液反应.
| A. | (1)(3) | B. | (2)(4) | C. | (4) | D. | (4)(5) |
7.下列有关有机物的叙述正确的是( )
| A. | 毛织、丝织衣服不宜用加酶洗衣粉洗涤 | |
| B. | 纤维素、淀粉、油脂均为天然高分子化合物 | |
| C. | 由煤的干馏可知煤中含甲苯、二甲苯、苯酚等芳香族化合物 | |
| D. | 向蛋白质溶液中滴入CuSO4溶液,蛋白质聚沉后还能溶于水 |
4.一定温度下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )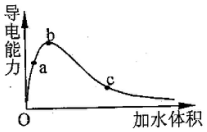

| A. | a,b,c三点溶液的pH:a>b>c | |
| B. | 若用湿润的pH试纸测试c处溶液的pH,比实际的pH偏小 | |
| C. | a,b,c三点溶液用1mol•L-1的NaOH溶液中和,消耗NaOH溶液的体积a>b>c | |
| D. | a,b,c点醋酸的电离程度:c>b>a |
17.一定温度下,把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(s)?x C(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol•L-1•s-1,同时生成1mol D,下列叙述中不正确的是( )
| A. | 反应达到平衡状态时A的转化率为60% | |
| B. | x=4 | |
| C. | 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6:5 | |
| D. | 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态 |
 如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题:
如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题: