题目内容
10.已知反应:①Cl2+2KBr═2KCl+Br2;②KClO3+6HCl═3Cl2↑+KCl+3H2O,下列说法正确的是( )| A. | 上述两个反应都是置换反应 | |
| B. | 反应①中若有1mol Br2生成,则转移电子的物质的量为2mol | |
| C. | 氧化性由强到弱顺序为:KClO3>Cl2>Br2 | |
| D. | 反应②中还原剂与氧化剂的物质的量之比为6:1 |
分析 A.置换反应中不仅有单质生成还必须有单质参加;
B.生成1mol溴需要得到2mol电子;
C.根据同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性来判断氧化性强弱;
D.先确定还原剂和氧化剂,再根据它们计量数之间的关系式判断.
解答 解:A.①为置换反应,②中生成物有单质但反应物没有单质,所以不是置换反应,故A错误;
B.反应①中溴离子从-1价变为0价,若有1mol Br2生成,则转移的电子的物质的量为:1mol×2×[0-(-1)]=2mol,故B正确;
C.Cl2+2KBr=2KCl+Br2中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,则氧化性强弱顺序是 KClO3>Cl2>Br2,故C正确;
D.②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,参加反应的$\frac{5}{6}$的氯化氢作还原剂,所以还原剂和氧化剂的物质的量之比是5:1,故D错误;
故选BC.
点评 本题考查了氧化还原反应,题目难度中等,明确元素化合价变化是解本题的关键,易错选项是D,注意该选项中不是所有氯化氢都参加氧化还原反应,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L四氯化碳所含分子的数目为0.5NA | |
| B. | 87g MnO2与4mol浓盐酸共热完全反应,能得到Cl2分子的数目为NA | |
| C. | 1mol Na2O2与足量CO2或水反应时,转移电子的数目为NA | |
| D. | 1mol/L的NaOH溶液中含Na+数目为NA |
1.将0.1mol/L的AlCl3溶液加热、蒸干、灼烧最后得到的固体是( )
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
18.向盛有10mL 1mol•L-1 NH4Al(SO4)2溶液的烧杯中滴加20mL 1.2mol•L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的质量为( )
| A. | 4.816g | B. | 0.78g | C. | 4.66g | D. | 5.44g |
5.指出下列化学事实中,影响化学反应速率的主要因素.
| 化学事实 | 主要影响因素 | |
| (1) | 集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 | |
| (2) | 黄铁矿煅烧前,要先粉碎成细小的矿粒 | |
| (3) | 实验室用浓盐酸而不用稀盐酸与MnO2反应制备氯气 |
10.下列关于热化学方程式$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=-4.5kJ•mol-1的叙述正确的是( )
| A. | 1molH2和1mol I2完全反应放出4.5kJ热量 | |
| B. | 1个氢分子和1个碘分子完全反应放出9kJ热量 | |
| C. | 1molH2和1mol I2完全反应生成气态HI放出9kJ热量 | |
| D. | 0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
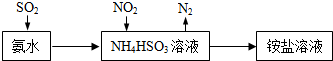
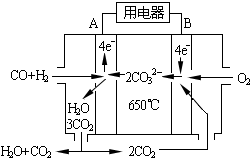 (6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.
(6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.