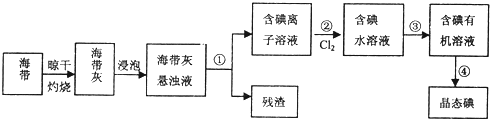
题目内容
下列实验操作正确的或能达到预期目的有几项( )
A.用饱和溴水除去甲苯中混有的苯酚
B.用氨水洗涤除去试管内壁上的银镜
C.实验室用加热NH4Cl固体使之分解的方法制NH3
D.用稀硫酸和Zn反应制H2时,加少量CuSO4溶液可加快反应速率
E.向煮沸的1mol?L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
F.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
G.用氢氧化铜粉末检测尿糖
H.实验室保存硝酸银溶液用棕色细口试剂瓶,而钠保存在盛有煤油的无色广口试剂瓶中
I.用玻璃棒蘸取待测液,点在湿润的pH试纸上测定其pH
J.检验某溶液里是否含有Fe2+时,可先滴加新制的氯水,再滴加KSCN溶液.
A.用饱和溴水除去甲苯中混有的苯酚
B.用氨水洗涤除去试管内壁上的银镜
C.实验室用加热NH4Cl固体使之分解的方法制NH3
D.用稀硫酸和Zn反应制H2时,加少量CuSO4溶液可加快反应速率
E.向煮沸的1mol?L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
F.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
G.用氢氧化铜粉末检测尿糖
H.实验室保存硝酸银溶液用棕色细口试剂瓶,而钠保存在盛有煤油的无色广口试剂瓶中
I.用玻璃棒蘸取待测液,点在湿润的pH试纸上测定其pH
J.检验某溶液里是否含有Fe2+时,可先滴加新制的氯水,再滴加KSCN溶液.
| A、两项 | B、三项 | C、四项 | D、五项 |
考点:化学实验方案的评价
专题:
分析:A.苯酚可以和浓溴水反应生成白色沉淀2,4,6-三溴苯酚和氢溴酸;
B.单质银与氨水不反应;
C.NH4Cl加热会分解出NH3和HCl;
D.原电池能加快化学反应速率.
E.NaOH溶液中滴加FeCl3溶液反应生成沉淀;
F.乙酸乙酯中加入饱和Na2CO3溶液,降低乙酸乙酯的溶解度、除去乙酸,吸收乙醇;
G.应利用氢氧化铜的悬浊液来检测尿糖.
H.见光易分解的溶液用棕色细口瓶保存,固体用广口瓶保存;
I.pH试纸用水润湿,会使溶液变稀;
J.检验亚铁离子要排除铁离子的干扰.
B.单质银与氨水不反应;
C.NH4Cl加热会分解出NH3和HCl;
D.原电池能加快化学反应速率.
E.NaOH溶液中滴加FeCl3溶液反应生成沉淀;
F.乙酸乙酯中加入饱和Na2CO3溶液,降低乙酸乙酯的溶解度、除去乙酸,吸收乙醇;
G.应利用氢氧化铜的悬浊液来检测尿糖.
H.见光易分解的溶液用棕色细口瓶保存,固体用广口瓶保存;
I.pH试纸用水润湿,会使溶液变稀;
J.检验亚铁离子要排除铁离子的干扰.
解答:
解:A.苯酚可以和浓溴水反应生成白色沉淀2,4,6-三溴苯酚和氢溴酸,甲苯和三溴苯酚是互溶的,过滤不到甲苯,故A错误;
B.单质银与氨水不反应,可用稀硝酸洗去,故B错误;
C.NH4Cl加热会分解出NH3和HCl,但到试管口附近遇冷又会重新结合生成NH4Cl,故不能用于制氨气,故C错误;
D.Zn置换出Cu后与CuSO4溶液一起构成原电池,反应速率加快,故D正确.
E.NaOH溶液中滴加FeCl3溶液反应生成沉淀,应向沸水中滴加饱和氯化铁溶液来制备胶体,故E错误;
F.乙酸乙酯中加入饱和Na2CO3溶液,降低乙酸乙酯的溶解度、除去乙酸,吸收乙醇,则向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸,故F正确;
G.应利用氢氧化铜的悬浊液来检测尿糖,出现砖红色沉淀可说明含有葡萄糖,不能利用氢氧化铜粉末检测尿糖,故G错误;
H.硝酸银见光易分解,溶液保存着细口瓶里,所以硝酸银溶液保存着棕色细口瓶中;钠易和水、氧气反应,所以要密封保存,钠的密度大于煤油且和煤油不反应,所以钠保存在盛有煤油的无色广口试剂瓶中,故H正确;
L.pH试纸用水润湿,会使溶液变稀,测得数据不准确,故I错误;
J.检验某溶液中是否含有亚铁离子时,应先滴加硫氰化钾溶液,再滴加新制氯水,故J错误.
故DFH正确.
故选B.
B.单质银与氨水不反应,可用稀硝酸洗去,故B错误;
C.NH4Cl加热会分解出NH3和HCl,但到试管口附近遇冷又会重新结合生成NH4Cl,故不能用于制氨气,故C错误;
D.Zn置换出Cu后与CuSO4溶液一起构成原电池,反应速率加快,故D正确.
E.NaOH溶液中滴加FeCl3溶液反应生成沉淀,应向沸水中滴加饱和氯化铁溶液来制备胶体,故E错误;
F.乙酸乙酯中加入饱和Na2CO3溶液,降低乙酸乙酯的溶解度、除去乙酸,吸收乙醇,则向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸,故F正确;
G.应利用氢氧化铜的悬浊液来检测尿糖,出现砖红色沉淀可说明含有葡萄糖,不能利用氢氧化铜粉末检测尿糖,故G错误;
H.硝酸银见光易分解,溶液保存着细口瓶里,所以硝酸银溶液保存着棕色细口瓶中;钠易和水、氧气反应,所以要密封保存,钠的密度大于煤油且和煤油不反应,所以钠保存在盛有煤油的无色广口试剂瓶中,故H正确;
L.pH试纸用水润湿,会使溶液变稀,测得数据不准确,故I错误;
J.检验某溶液中是否含有亚铁离子时,应先滴加硫氰化钾溶液,再滴加新制氯水,故J错误.
故DFH正确.
故选B.
点评:本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、X射线法、铜丝燃烧法、钠熔法、李比希燃烧法都是元素定性分析法 |
| B、日本福岛核电站释放的131I与137Cs,是两种不同的核素 |
| C、我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| D、氟氯烃是一种致冷剂,但它会破坏臭氧层,研究人员正在积极研发环保型的替代产品以减少氟氯烃的使用量 |
下列有关化学反应速率的说法正确的是( )
| A、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B、100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小 |
| C、SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢 |
| D、对于CaCO3+2HCl═CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示 |