题目内容
2.将两个铂电极放置在KOH溶液中,然后分别通入CH4 和O2,即可产生电流,称为燃料电池,下面叙述正确的是( )| A. | 通入CH4的电极为正极 | |
| B. | 通入CH4的电极反应为:CH4+10OH-→CO32-+7H2O+8e- | |
| C. | 通入O2的电极为负极 | |
| D. | 放电时溶液中阴离子向正极移动 |
分析 该燃料电池中,通入甲烷的电极是负极、通入氧气的电极是正极,电解质溶液呈碱性,通入CH4的电极电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的电极反应式为O2+2H2O+4e-=4OH-;放电时电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答 解:A.燃料电池中,通入燃料的电极上失电子发生氧化反应,所以通入燃料的电极是负极,则通入甲烷的电极是负极,故A错误;
B.通入甲烷的电极上失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH-→CO32-+7H2O+8e-,故B正确;
C.燃料电池中,通入氧气的电极上得电子发生还原反应,所以通入氧气的电极是正极,故C错误;
D.放电时,负极附近聚集大量阳离子,所以电解质溶液中阴离子向负极移动,正极上聚集大量电子,电解质溶液中阳离子向正极移动,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是D.

练习册系列答案
相关题目
17.氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业.考虑到生产实际经济效益吸收氯碱工业的尾气氯气最好采用( )
| A. | 浓NaOH溶液 | B. | 饱和食盐水 | C. | 石灰乳 | D. | 浓硫酸 |
7.化学家制造出一种物质“干水”,其每个颗粒含水95%,外层是沙质硅,干水吸收CO2的能力比普通水高三倍.下列说法正确的是( )
| A. | 干水是纯净物 | B. | 干水和干冰是同一种物质 | ||
| C. | 干水中的水分子不再运动 | D. | 用干水能更好地吸收CO2 |
14.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6gFe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1.0mol•L的NaCl 溶液中Na+数为NA | |
| C. | 16gCH4所含的电子数为10NA | |
| D. | 标况下,4.48L的水中含有H2O分子的数目为0.2NA |
11.某烃0.5mol最多能和1mol HCl加成,生成氯代烃,此氯代烃l mol能和4mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
 方案能达到实验目的的是()
方案能达到实验目的的是()
 相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象
相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象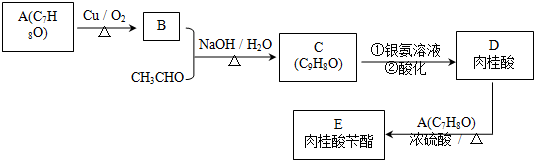

 .
. .
. .
. .
.