题目内容
7.常温下,用水稀释0.1mol•L-l CH3COOH溶液时,溶液中随着水量的增加而减小的是( )| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
分析 CH3COOH溶液中存在CH3COOH?CH3COO-+H+,加水稀释促进电离,溶液中n(CH3COO-)和n(H+)增大,但浓度减小,一定温度下存在离子积常数,氢离子女方和氢氧根离子浓度乘积为常数,以此解答该题.
解答 解:在用水稀释过程中,促进醋酸的电离,醋酸分子的物质的量减小,浓度减小;氢离子的物质的量增大,浓度减小;氢氧根的物质的量增大,浓度增加;温度不变Kw始终不变,
A.溶液中随着水量的增加,氢离子的物质的量增大,浓度减小,则c(OH-)增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故A不选;
B.加入水稀释,促进电离,CH3COOH物质的量减小,氢离子的物质的量增大,所以$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$减小,故B选;
C.温度一定溶液中存在离子积常数,c(H+)和c(OH-)的乘积不变,故C不选;
D.加水稀释促进电离,溶液中c(H+)减小,c(OH-)浓度增大,则OH-的物质的量,故D不选;
故选B.
点评 本题考查弱电解质的电离平衡问题、温度一定溶液中存在离子积常数,题目难度不大,注意把握弱电解质电离的特征以及影响平衡移动的因素.

练习册系列答案
相关题目
18.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | NaOH晶体中既含有离子键又含有共价键 | |
| D. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
15.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普通DNA链中的P元素 |
12.下列化学药品与其危险化学品图形标志不一致的是( )
| A. |  活性炭 | B. |  天然气 | C. |  酒精 | D. |  白磷 |
16.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )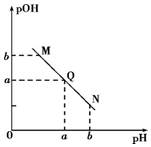

| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
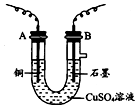 某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.