题目内容
13.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si
(2)画出原子的结构示意图:④
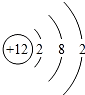 ,⑧
,⑧
(3)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素②的单质与水反应的化学方程式为2F2+2H2O=4HF+O2.
(6)元素⑤的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br;
(1)由位置可知元素;
(2)Mg的原子结构中含3个电子层,最外层电子数为2;Cl的原子结构中3个电子层,最外层电子数为7;
(3)同周期从左向右原子半径减小;
(4)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(5)F2与水反应生成HF和氧气;
(6)氢氧化铝与NaOH反应生成偏铝酸钠和水.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br;
(1)由位置可知①为N,⑥为Si,故答案为:N;Si;
(2)Mg的原子结构中含3个电子层,最外层电子数为2,原子结构示意图为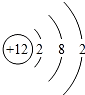 ;Cl的原子结构中3个电子层,最外层电子数为7,原子结构示意图为
;Cl的原子结构中3个电子层,最外层电子数为7,原子结构示意图为 ,故答案为:
,故答案为: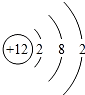 ;
; ;
;
(3)同周期从左向右原子半径减小,则第三周期(除稀有气体元素)中原子半径最大的元素是③,跟它同周期原子半径最小的元素是⑧,
故答案为:③;⑧;
(4)元素⑦与元素⑧相比,非金属性较强的是Cl,可利用氢化物的稳定性比较,故答案为:Cl;b;
(5)F2与水反应生成HF和氧气,反应为2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(6)氢氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 过渡元素包括七个副族和第Ⅷ族的元素 | |
| B. | 第3列中元素种类最多 | |
| C. | 第17列的第一种元素对应最高价氧化物的水化物是最强的含氧酸 | |
| D. | 第15列元素的氢化物组成通式可用RH3表示 |
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由强至弱的顺序是X>Y>Z | |
| C. | 原子半径大小顺序是X>Y>Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
①甲单质比乙单质更容易与H2化合;
②甲单质能与乙的阴离子发生置换反应;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙的低.
| A. | 只有④ | B. | 只有①②③ | C. | ①②③⑤ | D. | ①②③④⑤ |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素不能形成的离子化合物 |
| A. | X、Y、Z的稳定性逐渐减弱 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | X、Y、Z三种化合物的熔沸点逐渐升高 | |
| D. | 由A、B、C、D四元素间形成的化合物中只含共价键,不含离子键 |
| A. | 干冰的主要成分是H2O | B. | 吸入CO可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | 小苏打的主要成份是Na2CO3 |
 的系统命名是2,3-二甲基-1,3-戊二烯;
的系统命名是2,3-二甲基-1,3-戊二烯;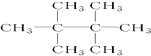 ,名称是2,2,3,3-四甲基丁烷;
,名称是2,2,3,3-四甲基丁烷; ;
; 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.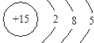 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.