题目内容
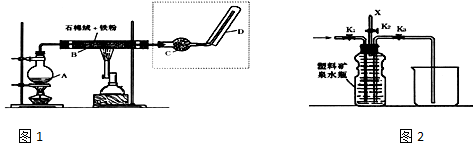
15.(1)在探究金属钠与水反应的实验过程中,某课外小组同学记录了如下实验现象和实验结论,请填写下表中的空格(从①~⑧中选择,填序号):①有碱生成 ②溶液变红 ③钠四处游动 ④钠浮在水面上 ⑤有气体产生 ⑥钠的密度比水小 ⑦钠熔成光亮的小球 ⑧反应放热,钠熔点低| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
分析 (1)钠的熔点较低,且密度小于水的密度,钠和水反应生成氢氧化钠和氢气,且该反应是放热反应,产生的氢气使钠受力不均匀,而导致钠四处游动,产生氢氧化钠而使其溶液呈碱性,碱遇酚酞试液变红色;
(2)少量金属钠投入到CuSO4溶液中,钠先与水反应,生成的氢氧化钠再与硫酸铜反应,生成氢氧化铜沉淀,所以发生的反应有2Na+2H2O═2NaOH+H2↑,2NaOH+CuSO4═Cu(OH)2↓+Na2SO4;
解答 解:(1)钠和水反应生成氢氧化钠和氢气,所以其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
⑦钠和水反应是放热反应,放出的热量使钠熔成小球,说明钠的熔点较低,故选⑧;
⑥钠的密度比水小,所以钠浮在水面上,故选④;
③钠四处游动,钠和水反应生成的氢气使钠受力不均匀而使钠四处游动,故选⑤;
①有碱性,钠和水反应生成氢氧化钠而使其溶液呈碱性,碱遇酚酞试液变红色,故选②;
故答案为:
| 实验现象 | ④ | ② | ||
| 实验结论 | ⑧ | ⑤ |
(2)少量金属钠投入到CuSO4溶液中,钠先与水反应,生成的氢氧化钠再与硫酸铜反应,生成氢氧化铜沉淀,所以发生的反应有2Na+2H2O═2NaOH+H2↑,2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,故选:C.
点评 本题考查钠的化学性质,根据实验现象得出正确结论,学生要清楚钠与盐溶液的反应,首先与溶剂水反应,然后根据生成的碱与溶质是否反应分析解答,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
5.下列化学用语表示正确的是( )
| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: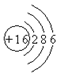 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
6.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
5.密闭容器中可逆反应2NO2(g)?N2O4(g)+Q(Q>0)达到平衡后,若增大压强,下列说法不正确的是( )
| A. | 混合气体颜色变浅 | B. | 逆反应速率加快 | ||
| C. | NO2转化率增大 | D. | 气体平均分子量变大 |