题目内容
20.(1)向200mL0.5mol/LAl2(SO4)3溶液中,加入350mL2mol/L NaOH溶液,充分反应后可以得到Al(OH)3沉淀多少g?(2)若想得到3.9g Al(OH)3沉淀,应向200mL0.5mol/LAl2(SO4)3溶液中加入2mol/L NaOH溶液多少mL?
分析 (1)Al2(SO4)3的物质的量为:0.2L×2mol/L=0.4mol,NaOH的物质的量为:0.35L×2mol/L=0.7mol,根据反应 Al2(SO4)3+6NaOH=2Al(OH)3↓+3 Na2SO4
、Al(OH)3+NaOH=NaAlO2+2H2O判断反应过量问题,进而计算得到沉淀的质量;
(2)根据Al2(SO4)3溶液与NaOH溶液的反应计算分析,200mL 0.5mol•L-1Al2(SO4)3全转化为沉淀的质量为:0.2L×0.5mol/L×2×78g/mol=15.6g,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答 解:(1)Al2(SO4)3的物质的量为:0.2L×0.5mol/L=0.1mol,NaOH的物质的量为:0.35L×2mol/L=0.7mol,则:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3 Na2SO4
1 6 2
0.1 0.6 0.2
Al(OH)3+NaOH=NaAlO2+2H2O
0.1mol (0.7-0.6)mol
则最后得到的沉淀的质量为:0.2mol-0.1mol=0.1mol,
所以生成白色沉淀的质量为:0.1mol×78g/mol=7.8g,
答:充分反应后可以得到Al(OH)3沉淀7.8g;
(2)在200mL 0.5mol•L-1的Al2(SO4)3溶液中加入2mol•L-1的NaOH溶液,如硫酸铝完全生成Al(OH)3,则沉淀的质量为:0.2L×0.5mol/L×2×78g/mol=15.6g,
而此时为3.9g,说明硫酸铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=$\frac{3.9}{78}$=0.05mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
①当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 1mol
x 0.05mol
则x=0.15mol,
V1(NaOH溶液)=$\frac{0.15mol}{2mol/L}$=75ml
②如使Al(OH)3部分溶解,则
Al3++3OH-=Al(OH)3↓
1mol 3mol 1mol
0.2mol 0.6mol 0.2mol
Al(OH)3 +OH -=AlO2-+2H2O
1mol 1mol
(0.2-0.05)mol 0.15mol
两步反应共需要0.6mol+0.15mol=0.75mol,
V2(NaOH溶液)=$\frac{0.75}{2}$=375mL
答:NaOH溶液75mL或375mL.
点评 本题考查化学方程式的计算、过量问题的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握根据反应物物质的量判断过量情况的方法,试题培养了学生的分析能力及化学计算能力.

| A. | 加入催化剂,改变了反应的途径,加快了反应速率,反应的△H也之改变 | |
| B. | 改变压强,反应速率发生改变,但平衡不发生移动,反应放出的热量不变 | |
| C. | 温度降低,正、逆反应速率都减小,反应放出的热量不变 | |
| D. | 恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
| A. | 2,3-二甲基-2-乙基己烷 | B. | CH3CH2CH2Cl氯丙烷 | ||
| C. |  属于芳香醇 属于芳香醇 | D. |  属于芳香化合物 属于芳香化合物 |
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
①每份均匀混合物的质量为16.8g
②硝酸的浓度为4mol/L
③V值为8960.
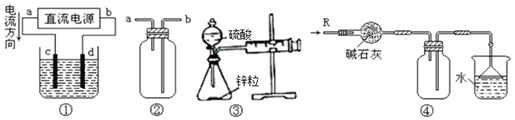
| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
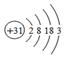 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |

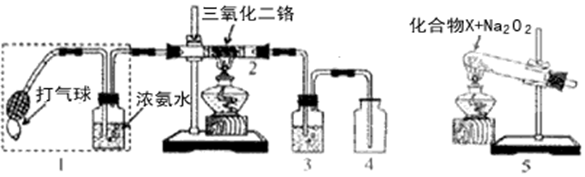
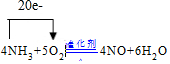 .
.