题目内容
4.向100ml水中投入Na和Al共15g,充分反应后,剩余金属为5g(1)计算放出H2多少升(标准状况下)
(2)过滤出未反应的金属,向滤液中逐滴加入4mol/L的HCl溶液,生成沉淀的最大值是多少?此时消耗HCl溶液的体积是多少?
分析 Al和水不反应,所以剩余金属应该是Al,涉及反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,结合方程式解答该题.
解答 解:(1)Al和水不反应,所以剩余金属应该是Al,则反应的金属共为10g,设Na为xmol,Al为ymol,
反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
由方程式可知x=y,23x+27y=10,
解得x=y=0.2,
则生成氢气的体积为22.4×(0.1+0.3)L=8.96L,
答:放出8.96L氢气;
(2)由方程式可知生成0.2molNaAlO2.向滤液中逐滴加入4mol/L的HCl溶液,最多可生成0.2mol氢氧化铝,质量为0.2mol×78g/mol=15.6g,
涉及方程式为NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,
可知n(HHCl)=0.2mol,
V(HCl)=$\frac{0.2mol}{4mol/L}$=0.05L=50mL,
答;生成沉淀的最大值是15.6g,此时消耗HCl溶液的体积是50mL.
点评 本题考查了有关混合物反应的计算,为高频考点,注意把握反应的相关方程式的书写,充分考查了学生的分析能力及化学计算能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.(1)在探究金属钠与水反应的实验过程中,某课外小组同学记录了如下实验现象和实验结论,请填写下表中的空格(从①~⑧中选择,填序号):①有碱生成 ②溶液变红 ③钠四处游动 ④钠浮在水面上 ⑤有气体产生 ⑥钠的密度比水小 ⑦钠熔成光亮的小球 ⑧反应放热,钠熔点低
(2)少量金属钠投入到CuSO4溶液中,正确的反应方程式是C
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
①2Na+CuSO4═Na2SO4+Cu↓
②Cu+2H2O═Cu(OH)2+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
A.①③B.①②C.③④D.①
19.已知C2H2在氧气充足时燃烧生成CO2,不足时生成CO,严重不足时生成碳.现将amolC2H2与bmolO2混合后在啊密闭容器中用电火花点燃.下列说法不正确的是( )
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
9.关于下列各装置图的叙述中,不正确的是( )

| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
16.某无色透明溶液中,能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、Cl- | B. | Ba2+、Na+、OH-、SO42- | ||
| C. | OH-、HCO3-、Mg2+、Na+ | D. | K+、Na+、OH-、NO3- |
13.根据元素周期表和元素周期律,分析下面的推断,其中错误的是( )
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
7.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
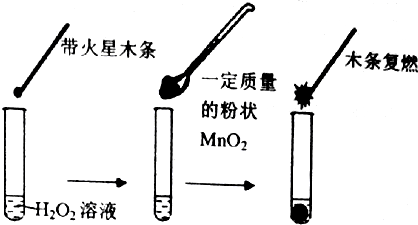
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
由此得到的结论是Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好,设计实验Ⅲ的目的是对比实验,证明Cl-对H2O2的分解没有催化作用.
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
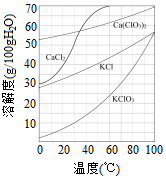 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:
 .
.