题目内容
7.常温下,金属镁与水反应很慢与盐酸反应很快的原因是盐酸中氢离子浓度大于水电离出氢离子浓度.分析 盐酸中氢离子浓度大于水电离出氢离子浓度,则氢离子浓度越大,反应越快,以此来解答.
解答 解:Mg与水或盐酸均反应生成氢气,常温下,金属镁与水反应很慢与盐酸反应很快的原因是盐酸中氢离子浓度大于水电离出氢离子浓度,
故答案为:盐酸中氢离子浓度大于水电离出氢离子浓度.
点评 本题考查金属的性质,为高频考点,把握氢离子浓度与反应速率的关系为解答的关键,侧重分析与应用能力的考查,注意反应实质的判断,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
18.物质的量相等的Na、Mg、Al分别跟足量稀H2SO4反应,产生的氢气的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:1 |
15.下列做法一定能增加化学反应速率的是( )
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
2.关于NaClO+CO2+H2O=NaHCO3+HClO 之所以能发生解释正解的是( )
| A. | 该反应不能发生,不符合复分解反应发生条件,无沉淀或气体或水,应该左右倒过来写 | |
| B. | 该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理 | |
| C. | 该反应不是复分解反应是氧化还原反应,自然不能套用复分解反应条件或规律 | |
| D. | 该反应可能是NaHCO3难溶于水,正好符合复分解反应发生条件之一 |
12.常温下测得某无色溶液中由水电离出c (H+)为10-13mol/L,该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
19.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol Al3+离子含有的核外电子数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 10 LpH=l的硫酸溶液中含有的H+离子数为NA | |
| D. | 1L0.5mol/L的碳酸钠溶液中含有的CO32-离子数为0.5NA |
16.阿斯巴甜是目前使用最广泛的甜味剂.甜度约为蔗糖的200倍,其结构简式为:
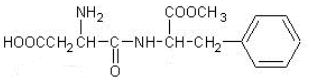
下列关于阿斯巴甜的说法正确的是( )

下列关于阿斯巴甜的说法正确的是( )
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
17.下列离子方程式中正确的是( )
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |