题目内容
3.如图是Cu-Zn原电池的装置示意图,下列叙述正确的是( )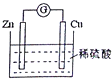
| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
分析 Cu-Zn-稀硫酸原电池放电时,化学能转变为电能,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,据此分析.
解答 解:A、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故A错误;
B、较不活泼的金属铜作正极,正极H+在铜片上得电子发生还原反应,故B正确;
C、该原电池放电时,化学能转变为电能,较活泼的金属锌作负极,且锌片逐渐被消耗,故C错误;
D、电子从负极锌片沿导线流向正极铜片,不经过溶液,故D错误.
故选B.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断电子从负极锌片沿导线流向正极铜片,不经过溶液.

练习册系列答案
相关题目
13.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),若该化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
14.某原电池装置图如图所示,有关该原电池的说法正确的是( )
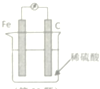

| A. | 在铁棒上产生气泡,碳棒上没有气泡 | |
| B. | H+在溶液中定向流向铁 | |
| C. | 电子由铁电极经导线流向碳棒 | |
| D. | 该装置能将电能转化为化学能 |
18.为探索生命现象中的有关微观变化,科学家常以${\;}_{6}^{14}$C标记的化合物为示踪剂,下列关于${\;}_{6}^{14}$C的说法中正确的是
( )
( )
| A. | 质量数是6 | B. | 质子数是6 | C. | 电子数是14 | D. | 中子数是14 |
8.下列有关硅及其化合物的说法治确的是( )
| A. | 单晶硅太阳能电池的光电转换效率为100% | |
| B. | 高溫下碳能将二氧化硅还原为硅,则C的非金属性比Si强 | |
| C. | Mg2Si与盐酸作用制得硅烷的方程式为:Mg2Si+4HCl═2MgCl2+SiH4↑ | |
| D. | 一种硅酸盐云母[KAl2(AlSi3O10)(OH)2用氧化物形式可表示为:K2O•3Al2O3•6SiO2•H2O |
15.某课外学习小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,先慢慢通入O2,一段时间后,再喷射蒸馏水即得硫酸型酸雨.则关于NO的作用说法正确的是( )
| A. | 还原剂 | B. | 氧化剂 | C. | 反应物 | D. | 催化剂 |
13.某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):
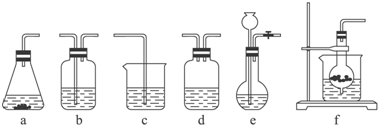
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好.
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):

请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
| 分项 内容 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | c | ||
| 选择的药品(填序号) | ① |
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,Y装置中除去的杂质为HCl.
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3.
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过4.37%(质量分数).
附:有关物质在常温(25℃)时的溶解度
| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |