题目内容
20.下列各组中的离子,能在溶液中大量共存的是( )| A. | H+、K+、NO3-、OH- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | H+、Zn2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、OH- |
分析 A.氢离子与氢氧根离子反应生成水;
B.钡离子与碳酸根离子反应生成难溶物碳酸钡;
C.四种离子之间不反应,能够共存;
D.镁离子与氢氧根离子反应生成难溶物氢氧化镁.
解答 解:A.H+、OH-之间发生反应生成水,在溶液中不能大量共存,故A错误;
B.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故B错误;
C.H+、Zn2+、Cl-、SO42-之间不反应,在溶液中能够大量共存,故C正确;
D.Mg2+、OH-之间反应生成氢氧化镁沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
10.加入适量的H2SO4溶液,可使下列离子在溶液中的数目显著减少的是( )
| A. | Cl- | B. | NO3- | C. | Na+ | D. | CO3- |
8.下列说法正确的是( )
| A. | 原子序数越大,原子半径一定越大 | |
| B. | 电子层数多的原子的半径一定比电子层数少的大 | |
| C. | 原子序数大的原子,最外层电子数越多 | |
| D. | 元素原子最外层电子数越多(除稀有气体),可显示的化合价不一定越高 |
15.下列实验方案不能达到预期目的是( )
| A. | 用Na、Mg分别与冷水反应的实验来证明Na、Mg的金属性强弱 | |
| B. | 用MgCl2和AlCl3分别与过量氨水反应的实验证明Mg、Al的金属性强弱 | |
| C. | 用MgCl2和AlCl3分别与过量NaOH溶液逐步反应的实验证明Mg、Al的金属性强弱 | |
| D. | 用Mg(OH)2和Al(OH)3分别与强碱反应的实验来证明Mg、Al的金属性强弱 |
5.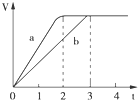 镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
 镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 镁粉和铝粉的物质的量之比为3:2 | |
| B. | 镁粉和铝粉质量之比为3:2 | |
| C. | 镁粉和铝粉的摩尔质量之比为2:3 | |
| D. | 镁粉和铝粉反应完所需时间之比为3:2 |
12.下列关于碳酸钠和碳酸氢钠的叙述,正确的是( )
| A. | 常温时,在水中的溶解性:碳酸钠>碳酸氢钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠 | |
| D. | 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠 |
10.下列关于乙烯的说法不正确的是( )
| A. | 是无色液体 | |
| B. | 可做水果催熟剂 | |
| C. | 能使KMnO4酸性溶液褪色 | |
| D. | 能跟溴的四氯化碳溶液发生加成反应 |