题目内容
17.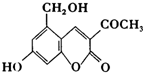 “亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:
“亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:(1)“亮菌甲素”的分子式为C12H10O5.
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在.写出其属于醇类的同分异构体的结构简式CH3CH(OH)CH2OH、CH2(OH)CH2CH2(OH).
(3)下列有关“亮菌甲素”的叙述正确的是AD(填序号).
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1mol“亮菌甲素”最多与3molNaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2:2:1.又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2.写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式HOCH2CH2OCH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$HOCH2CH2OCH2CH2OOCCH3+H2O.
分析 (1)由结构简式可知分子式;
(2)丙二醇的分子式是C3H8O2,则2个-OH在不同的C原子上;
(3)含碳碳双键、酚-OH、醇-OH及-COOC-,结合烯烃、酚、醇、酯的性质分析;
(4)有3个吸收峰,其峰面积之比为2:2:1,则含3种位置的H,C、O元素的质量分数相同,且H的质量分数为9.4%,则$\frac{0.5×(1-9.4%)}{12}$:$\frac{0.5×(1-9.4%)}{16}$:$\frac{9.4%}{1}$=4:3:10,1mol二甘醇与足量金属钠反应生成1mol H2,则含2个-OH,二甘醇为HOCH2CH2OCH2CH2OH,与乙酸可发生酯化反应.
解答 解:(1)由结构简式可知分子式为C12H10O5,故答案为:C12H10O5;
(2)丙二醇的分子式是C3H8O2,则2个-OH在不同的C原子上,属于醇类的同分异构体的结构简式CH3CH(OH)CH2OH、CH2(OH)CH2 CH2(OH),
故答案为:CH3CH(OH)CH2OH、CH2(OH)CH2 CH2(OH);
(3)A.“亮菌甲素”含苯环和双键,能与H2发生加成反应,故A正确;
B.含双键,能使酸性KMnO4溶液褪色,故B错误;
C.“亮菌甲素”分子中含氧官能团为酚-OH、醇-OH及-COOC-,有3种,故C错误;
D.酚-OH、-COOC-及水解生成的酚-OH均与NaOH反应,1mol“亮菌甲素”最多与3mol NaOH反应,故D正确;
故答案为:AD;
(4)有3个吸收峰,其峰面积之比为2:2:1,则含3种位置的H,C、O元素的质量分数相同,且H的质量分数为9.4%,则$\frac{0.5×(1-9.4%)}{12}$:$\frac{0.5×(1-9.4%)}{16}$:$\frac{9.4%}{1}$=4:3:10,1mol二甘醇与足量金属钠反应生成1mol H2,则含2个-OH,二甘醇为HOCH2CH2OCH2CH2OH,与乙酸发生酯化反应为HOCH2CH2OCH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$HOCH2CH2OCH2CH2OOCCH3+H2O,
故答案为:HOCH2CH2OCH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$HOCH2CH2OCH2CH2OOCCH3+H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,注意(4)中有机物的推断为解答的难点,题目难度中等.

①用气态燃料代替液态和固态燃料作为发动机动力来源
②开发生产无汞电池
③提倡使用手帕,减少餐巾纸的使用
④分类回收垃圾
⑤开发无磷洗涤剂
⑥提倡使用一次性发泡塑料餐具和塑料袋.
| A. | ①②③⑥ | B. | ③④⑤⑥ | C. | ①②③④⑤ | D. | 全部 |
| A. | 26g乙炔所含共用电子对数目为3 NA | |
| B. | 标准状况下,11.2L的新戊烷所含的分子数为0.5 NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA | |
| D. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| A. | 6 | B. | 8 | C. | 9 | D. | 11 |
| 编号 | 电极材料 | 电解质溶液 | 灵敏电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极是否相同?否(用“是”或“否”回答);
(2)写出实验3中的电极名称和电极反应式:
铝为负极极,2Al-6e-═2Al3+;
石墨为正极,6H++6e-═3H2↑(;
(3)实验4中的铝为负极,写出电池总反应方程式2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(4)解释实验5中灵敏电流计指针偏向铝的原因:Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由负极流向正极,所以电流计指针偏向铝
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子,做负极,反之作正极,与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关.
| A. | 只含一个双键的链状化合物 | B. | 含一个双键的环状化合物 | ||
| C. | 含一个三键的链状化合物 | D. | 含两个双键的链状化合物 |
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
(1)②和⑧两元素所对应的氢化物,最稳定的是HF(填化学式);
(2)③和⑥两元素的最高价氧化物对应水化物的反应是放热(填“放热”或“吸热”)反应;
(3)①⑤⑦三种元素的最高价氧化物对应水化物,酸性由强到弱的顺序是H2CO3>H2SiO3>Al(OH)3(填化学式).
 或
或 .
.