题目内容
1.实验室加热氯酸钾(KClO3)和二氧化锰的混合物制取氧气.若收集到标准状况下6.72L O2,至少需要多少克氯酸钾?同时生成氯化钾的物质的量为多少mol?分析 发生反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,生成氧气的物质的量为:n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合反应方程式及原子守恒计算即可.
解答 解:(1)收集到标准状况下6.72L氧气的物质的量为:n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
由2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑可知,n(KClO3)=0.3mol×$\frac{2}{3}$=0.2mol,其质量为0.2mol×122.5g/mol=24.5g,
答:至少需要24.5克氯酸钾;
(2)由反应2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑可知,n(KCl)=n(KClO3)=0.2mol,
答:生成氯化钾的物质的量为0.2mol.
点评 本题考查根据方程式进行的计算,为高频考点,比较基础,旨在考查学生对基础知识的理解掌握,注意对基础知识的掌握.

练习册系列答案
相关题目
10.CO和NO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳.对此反应下列叙述正确的是( )
| A. | 使用催化剂不改变反应速率 | B. | 降低压强能加快反应速率 | ||
| C. | 升高温度能加快反应速率 | D. | 改变压强对反应速率无影响 |
12.(1)下面不是污水处理方法的是A(填字母)A.过滤法 B.混凝法 C.中和法 D.沉淀法天然水中含有细菌,其主要成分是蛋白质,家庭中能杀灭水中细菌的简单方法:①添加合适的消毒剂、②加热或紫外线消毒等;
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2.利用下列试剂中的一部分或全部,设计软化该水的实验方案.可选试剂:①Ca(OH)2溶液;②NaOH溶液;③饱和Na2CO3溶液;④肥皂水.实验方案:(填写下表)
(3)利用海水得到淡水的方法有蒸馏法、电渗析法等.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示.
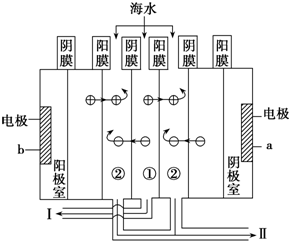
a接电源的负极,Ⅰ口排出的是淡水(填“淡水”或“海水”);
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1 000t该浓海水需标准状况下的氯气的体积为1400am3.
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2.利用下列试剂中的一部分或全部,设计软化该水的实验方案.可选试剂:①Ca(OH)2溶液;②NaOH溶液;③饱和Na2CO3溶液;④肥皂水.实验方案:(填写下表)
| 实验步骤 |
| 向硬水中加入①(填序数),直到不再产生沉淀为止. |
| 继续向溶液中加入③(填序数),直到不再产生沉淀为止. |
| 将上述混合物过滤(填操作) |

a接电源的负极,Ⅰ口排出的是淡水(填“淡水”或“海水”);
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1 000t该浓海水需标准状况下的氯气的体积为1400am3.
16.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向盛有1mL2%的硝酸银溶液中逐滴加入2%稀氨水,边滴边振荡至最初产生的沉淀恰好消失为止 | 配制少量银氨溶液 |
| B | 向盛有2mL10%的硫酸铜溶液的试管中滴加0.5mL10%氢氧化钠溶液,混合均匀,滴入待检液,加热 | 检验某溶液中是否含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
6.下列反应属于氧化还原反应的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | NH3+HCl═NH4Cl | ||
| C. | 2 NaOH+SO2═Na2SO3+H2O | D. | AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl |
13.除去蛋清中混有的少量Cl-的方法是( )
| A. | 加入少量硝酸银溶液 | B. | 过滤 | ||
| C. | 电泳 | D. | 渗析 |
11.下列物质的类别与所含官能团都正确的是( )
| A. | 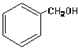 酚类-OH 酚类-OH | B. | 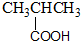 羧酸-CHO 羧酸-CHO | ||
| C. | 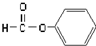 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 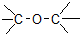 |
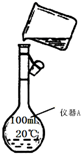 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
 .
.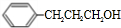
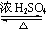
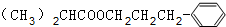 +H2O.
+H2O. .
.