题目内容
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH和H2O为原料制备二甲醚和甲醇的工业流程如下:请回答下列有关问题:
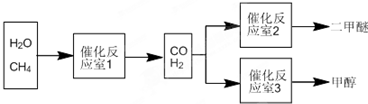
(1)在一定条件下,催化反应室1中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H<0.在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).将1mol CH4和2mol H2O通入催化反应室1(假设容积为100L),10min末有0.1mol CO生成,则10min内反应的平均速率v(H2)= .在催化反应室3中(假设容积为V L)发生反应:CO(g)+2H2(g)?CH3OH(g)△H=-Q kJ?mol-1.
①将a mol CO与2a mol H2通入催化反应室3,则反应达到平衡时,放出热量 (大于,小于,等于) 2aQ kJ.
②一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母编号).
a.高温高压 b.加入催化剂 c.增加H2的浓度d.增加CO的浓度 e.分离出甲醇
③在一定条件下,若CO的平衡转化率为50%,此反应的平衡常数K= (用含a、V的代数式表示).
(3)二甲醚(CH3OCH3)也是一种重要的清洁燃料,可替代氟利昂作制冷剂等,对臭氧层无破坏作用.利用甲醇可以合成二甲醚,反应原理为:2CH3OH(g)?CH3OCH3(g)+H2O(g).某温度下此反应的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率为 ,体系CH3OCH3的体积分数 (计算结果保留三位有效数字).

(1)在一定条件下,催化反应室1中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H<0.在其它条件不变的情况下降低温度,逆反应速率将
①将a mol CO与2a mol H2通入催化反应室3,则反应达到平衡时,放出热量
②一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是
a.高温高压 b.加入催化剂 c.增加H2的浓度d.增加CO的浓度 e.分离出甲醇
③在一定条件下,若CO的平衡转化率为50%,此反应的平衡常数K=
(3)二甲醚(CH3OCH3)也是一种重要的清洁燃料,可替代氟利昂作制冷剂等,对臭氧层无破坏作用.利用甲醇可以合成二甲醚,反应原理为:2CH3OH(g)?CH3OCH3(g)+H2O(g).某温度下此反应的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
考点:用化学平衡常数进行计算,化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)温度对正逆反应速率的影响一致,升高反应速率增大,降低温度反应速率减小;根据v=
计算出v(CO),再根据速率之比等于化学计量数之比计算v(H2);
①根据热化学方程式的含义以及可逆反应的特点来回答;
②提高CO的转化率,可使化学平衡正向移动,加压、减小生成物的浓度、增大氢气的浓度、降温等均能使反应正向移动,以此来解答;
③根据平衡常数概念,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积求解;
(3)根据方程式计算平衡常数,然后利用三段式法解答.
| △n |
| △t |
①根据热化学方程式的含义以及可逆反应的特点来回答;
②提高CO的转化率,可使化学平衡正向移动,加压、减小生成物的浓度、增大氢气的浓度、降温等均能使反应正向移动,以此来解答;
③根据平衡常数概念,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积求解;
(3)根据方程式计算平衡常数,然后利用三段式法解答.
解答:
解:(1)温度对正逆反应速率的影响一致,降低温度反应速率减小;
v(CO)=
=0.0001mol?L-1?min-1,
速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mol?L-1?min-1=0.0003mol?L-1?min-1.
故答案为:减小;0.0003mol?L-1?min-1;
①该反应为可逆反应,将a mol CO与2a mol H2通入催化反应室3,不可能完全转化,所以达到平衡时放出热量小于2aQ kJ,
故答案为:小于;
②a.因该反应为气体体积减小的反应,则加压(缩小体积)化学平衡正向移动,CO的转化率增大,因该反应为放热反应,则升温平衡逆向移动,CO的转化率降低,故a不选;
b.加催化剂对平衡移动无影响,CO的转化率不变,故b不选;
c.增大H2的浓度,化学平衡正向移动,CO的转化率增大,故c选;
d.增大CO的浓度,化学平衡正向移动,但CO的转化率减小,故d不选;
e.分离出甲醇,化学平衡正向移动,CO的转化率增大,故e选;
故选ce;
③达到平衡时,CO的转化率为0.5,则
CO(g)+2H2(g)?CH3OH(g),
开始(mol/L):
0
变化(mol/L):
平衡(mol/L):
代入平衡常数k=
=
=
,
故答案为:
;
(3)2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol?L-1):0.44 0.6 0.6
转化浓度(mol?L-1):2x x x
平衡浓度(mol?L-1):0.44-2x 0.6+x 0.6+x
K=
=400,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,故平衡时CH3OH的转化率为
≈24.4%,
平衡时c(CH3OCH3)=c(H2O)=0.6+0.2=0.8mol/L,
体系CH3OCH3的体积分数
≈48.8%,
故答案为:24.4%;48.8%.
v(CO)=
| 0.1mol | ||
|
速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mol?L-1?min-1=0.0003mol?L-1?min-1.
故答案为:减小;0.0003mol?L-1?min-1;
①该反应为可逆反应,将a mol CO与2a mol H2通入催化反应室3,不可能完全转化,所以达到平衡时放出热量小于2aQ kJ,
故答案为:小于;
②a.因该反应为气体体积减小的反应,则加压(缩小体积)化学平衡正向移动,CO的转化率增大,因该反应为放热反应,则升温平衡逆向移动,CO的转化率降低,故a不选;
b.加催化剂对平衡移动无影响,CO的转化率不变,故b不选;
c.增大H2的浓度,化学平衡正向移动,CO的转化率增大,故c选;
d.增大CO的浓度,化学平衡正向移动,但CO的转化率减小,故d不选;
e.分离出甲醇,化学平衡正向移动,CO的转化率增大,故e选;
故选ce;
③达到平衡时,CO的转化率为0.5,则
CO(g)+2H2(g)?CH3OH(g),
开始(mol/L):
| a |
| V |
| 2a |
| V |
变化(mol/L):
| 0.5a |
| V |
| a |
| V |
| 0.5a |
| v |
平衡(mol/L):
| 0.5a |
| v |
| a |
| v |
| 0.5a |
| v |
代入平衡常数k=
| c(CH3OH) |
| c(CO)[c(H2)]2 |
| ||||
(
|
| v2 |
| a2 |
故答案为:
| v2 |
| a2 |
(3)2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol?L-1):0.44 0.6 0.6
转化浓度(mol?L-1):2x x x
平衡浓度(mol?L-1):0.44-2x 0.6+x 0.6+x
K=
| (0.6+x)2 |
| (0.44-2x)2 |
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,故平衡时CH3OH的转化率为
| 0.4 |
| 1.64 |
平衡时c(CH3OCH3)=c(H2O)=0.6+0.2=0.8mol/L,
体系CH3OCH3的体积分数
| 0.8 |
| 0.04+0.8+0.8 |
故答案为:24.4%;48.8%.
点评:本题考查了化学平衡的计算,主要是平衡浓度、平衡转化率、平衡常数的计算应用,注意对公式的理解与灵活运用,注意三段式应用,题目难度中等.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
下列说法正确的是( )
| A、加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,一定有SO42- |
| B、Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 |
| C、向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 |
| D、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等 |
已知C(石墨)→C(金刚石),△H=+119KJ/mol,则可判断( )
| A、金刚石比石墨稳定 |
| B、一样稳定 |
| C、石墨比金刚石稳定 |
| D、无法判断 |
V L Na2SO4溶液中含Na+mg,取出10mL稀释成50mL,则稀释后溶液中SO42-的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
稀HNO3与某二价金属反应时被还原的硝酸占其总消耗量的
,则该反应中可能的还原产物是( )
| 1 |
| 6 |
| A、N2 |
| B、NO |
| C、N2O |
| D、NH4NO3 |
 在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )
在如图所示的装置中,溶液的体积均为1L,浓度均为0.1mol?L-1.工作一段时间后,测得电路中均通过了0.02mol e-.下列叙述中正确的是( )