题目内容
4.某有机物X,在标准状况下的密度为2.679g/L.把1.8g X完全燃烧,将燃烧产物通过浓硫酸,则浓硫酸增重2.16g;若将燃烧产物通过碱石灰,则碱石灰增重6.12g.则该有机物的分子式为C3H8O,该有机物可能有的结构简式为CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3(不一定要填满,有几种填几种).分析 X在标准状况下的密度为2.679g/L,则摩尔质量为2.679g/L×22.4L/mol=60g/mol,n(X)=$\frac{1.8g}{60g/mol}$=0.03mol,浓硫酸增重为水的质量,则n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,将燃烧产物通过碱石灰,则碱石灰增重6.12g,则n(CO2)=$\frac{6.12g-2.16g}{44g/mol}$=0.09mol,结合原子守恒来解答.
解答 解:X在标准状况下的密度为2.679g/L,则摩尔质量为2.679g/L×22.4L/mol=60g/mol,n(X)=$\frac{1.8g}{60g/mol}$=0.03mol,浓硫酸增重为水的质量,则n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,将燃烧产物通过碱石灰,则碱石灰增重6.12g,则n(CO2)=$\frac{6.12g-2.16g}{44g/mol}$=0.09mol,
则X中含C原子为$\frac{0.09mol}{0.03mol}$=3,含H原子为$\frac{0.12mol×2}{0.03mol}$=8,含O原子为$\frac{60-12×3-1×8}{16}$=1,则X的分子式为C3H8O,由烷烃中H原子个数为C原子个数的2倍+2,则X为饱和一元醇或醚,可能的结构简式为CH3CH2CH2OH、CH3CHOHCH3、CH3OCH2CH3,
故答案为:C3H8O;CH3CH2CH2OH;CH3CHOHCH3;CH3OCH2CH3.
点评 本题考查有机物的推断,为高频考点,把握燃烧规律、原子守恒为解答的关键,侧重分析与能力推断的考查,注意摩尔质量的计算及烷烃组成的应用,题目难度不大.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪经) | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| A. | 5、9、6 | B. | 4、6、6 | C. | 3、9、7 | D. | 4、6、7 |
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→A、B→C、D→E:广口瓶Ⅱ中的试剂为饱和食盐水.
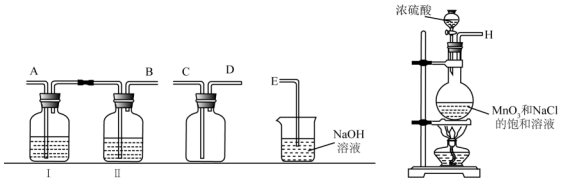
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
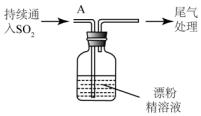 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
②该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀.
实验a的目的是排除氯气干扰
③推测ii中溶液变为黄绿色,是由于产生了Cl2(写化学式),iii中产生的大量白色沉淀应为CaSO4(写化学式)
| A. | 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液 | |
| B. | 可用勒夏特列原理解释2NO2(g)?N2O4(g)体系加压后颜色变深 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0可通过加压方式增大其平衡常数 | |
| D. | 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体 |
 常温下,向20mL0.1mol•L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的氢离子浓度随加入硫酸的体积变化如图.下列说法错误的是( )
常温下,向20mL0.1mol•L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的氢离子浓度随加入硫酸的体积变化如图.下列说法错误的是( )| A. | 若a等于1.0×10-11 mol•L-1,则此时氨水的电离度为1% | |
| B. | c点时氨水与硫酸恰好完全反应 | |
| C. | c点所示溶液中:c(H+)-c(OH-)═c(NH3•H2O) | |
| D. | 若b、d对应的水电离的氢离子浓度为1.0×10-7 mol•L-1,此时两溶液中都存在:c(NH4+)═2c(SO42-) |