题目内容
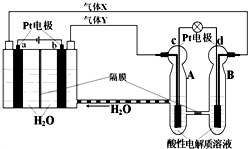 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )| A、转移0.1mol电子时,a电极产生标准状况下O21.12L |
| B、b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D、d电极上发生的电极反应是:O2+4H++4e-=2H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:依据图示知左边装置是电解池,右边装置是原电池,ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;cd电极是原电池的正负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,结合电极上的电子守恒分析计算.
原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,结合电极上的电子守恒分析计算.
解答:
解:A.当有0.1 mol电子转移时,a电极为电解池的阴极,电极反应为4H++4e-=2H2↑,产生1.12LH2,故A错误;
B.b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑,故B错误;
C.c电极上氧气得到发生还原反应,为原电池的正极,阳离子在原电池中移向正极,B池中的H+可以通过隔膜进入A池,故C正确;
D.d为负极失电子发生氧化反应:2H2-4e-=4H+,故D错误;
故选C.
B.b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑,故B错误;
C.c电极上氧气得到发生还原反应,为原电池的正极,阳离子在原电池中移向正极,B池中的H+可以通过隔膜进入A池,故C正确;
D.d为负极失电子发生氧化反应:2H2-4e-=4H+,故D错误;
故选C.
点评:本题考查了化学电源新型电池,主要考查原电池和电解池的工作原理、电极判断、电极反应,注意原电池中电解质溶液是酸而不是碱,电极反应式的书写是易错点.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列反应的离子方程式不正确的是( )
| A、醋酸加入氨水:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O |
| B、铜片插入硝酸银溶液:Cu+Ag+=Cu 2++Ag |
| C、碳酸钙加入醋酸:CO32-+2 CH3COOH=CO2↑+2 CH3COO-+H2O |
| D、澄清的石灰水跟盐酸反应:H++OH-=H2O |
将0.2mol/L的FeBr2与0.1mol/L FeI2溶液等体积混合后,慢慢通入一定体积的氯气,可能发生的离子反应方程式为( )
| A、Cl2+2Fe2+→2Cl-+2Fe3+ |
| B、2Cl2+2Fe2++2I-=2Fe3++4Cl-+I2 |
| C、3Cl2+2Fe2++4Br-→2Fe3++6Cl-+2Br2 |
| D、6Cl2+6Fe2++4I-+2Br-=6Fe3++12Cl-+2I2+Br2 |
下列对非金属元素(除稀有气体元素外)的相关判断正确的是( )
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价.
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价.
| A、②⑤ | B、①③⑤ |
| C、②③④ | D、①⑤ |
试管中盛有白色晶体,检验它是不是铵盐的方法中不可行的是( )
| A、加热,将湿润的红色石蕊试纸放在管口 |
| B、加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 |
| C、加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口 |
| D、加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |






