题目内容
由Fe、Fe2O3、CuO组成的混合物溶于220mL,2mol/L的过量盐酸中,产生H2 896mL(标况),所得溶液中阳离子只有Fe2+和H+,残余固体为1.28g,过滤后将滤液稀释为400mL,测得c(H+)为0.2mol/L,则原混合物中各组分的质量为:CuO g,Fe2O3 g,Fe g.
考点:有关混合物反应的计算
专题:
分析:稀释后的滤液中c(H+)为0.2mol/L,则Fe完全反应;由于过滤后,滤液中的金属离子只有Fe2+,故固体和盐酸反应后的盐只有氯化亚铁,则固体与稀盐酸反应后的溶液是盐酸和氯化亚铁的混合物,不溶物1.28g为Cu,根据稀释后氢离子浓度计算出剩余氯化氢的物质的量,其余的氯离子与亚铁离子构成氯化亚铁,根据氯离子守恒n(FeCl2)=n(HCl),设混合物中Fe为xmol,Fe2O3为ymol,根据Fe元素守恒及转移电子守恒列方程计算解答.
解答:
解:稀释后的滤液中c(H+)为0.2mol/L,则氢离子的物质的量为n(H+)=0.2mol/L×0.4L=0.08mol,则反应后剩余氯化氢的物质的量为0.08mol,则铁完全反应,
由于过滤后,滤液中的金属离子只有Fe2+,故固体和盐酸反应后的盐只有氯化亚铁,则固体与稀盐酸反应后的溶液是盐酸和氯化亚铁的混合物,不溶物1.28g为Cu,根据铜元素守恒可知CuO的物质的量为:
=0.02mol;
其余的氯离子与亚铁离子构成氯化亚铁,根据氯离子守恒n(FeCl2)=
n(HCl)=
(2mol/L×0.22L-0.08mol)=0.18mol,
生成氢气的物质的量为:
=0.04mol,
设混合物中Fe为xmol,Fe2O3为ymol,
根据Fe元素守恒:x+2y=0.18,
根据电子转移守恒:2x=2y+0.02×2+0.04×2,
联立方程,解得:x=0.1、y=0.04,
即:原混合物中含有0.02molCuO、0.1molFe、0.04molFe2O3,
则氧化铜的质量为:80g/mol×0.02mol=1.6g;氧化铁的质量为:160g/mol×0.0mol=6.4g;铁的质量为:56g/mol×0.1mol=5.6g,
故答案为:1.6;6.4;5.6.
由于过滤后,滤液中的金属离子只有Fe2+,故固体和盐酸反应后的盐只有氯化亚铁,则固体与稀盐酸反应后的溶液是盐酸和氯化亚铁的混合物,不溶物1.28g为Cu,根据铜元素守恒可知CuO的物质的量为:
| 1.28g |
| 64g/mol |
其余的氯离子与亚铁离子构成氯化亚铁,根据氯离子守恒n(FeCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
生成氢气的物质的量为:
| 0.896L |
| 22.4L/mol |
设混合物中Fe为xmol,Fe2O3为ymol,
根据Fe元素守恒:x+2y=0.18,
根据电子转移守恒:2x=2y+0.02×2+0.04×2,
联立方程,解得:x=0.1、y=0.04,
即:原混合物中含有0.02molCuO、0.1molFe、0.04molFe2O3,
则氧化铜的质量为:80g/mol×0.02mol=1.6g;氧化铁的质量为:160g/mol×0.0mol=6.4g;铁的质量为:56g/mol×0.1mol=5.6g,
故答案为:1.6;6.4;5.6.
点评:本题考查了有关混合物的计算,题目难度中等,明确发生的反应为解答关键,注意利用原子守恒与电子转移守恒进行解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
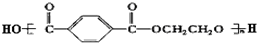
下列有关化学用语正确的是( )
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: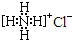 | ||
C、F-结构示意图: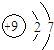 | ||
D、中子数为20的氯原子:
|
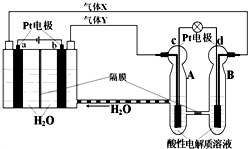 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )| A、转移0.1mol电子时,a电极产生标准状况下O21.12L |
| B、b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D、d电极上发生的电极反应是:O2+4H++4e-=2H2O |
现有铜质印刷线路板浸入200 mL氯化铁溶液中,有6.4g铜被腐蚀掉.取出印刷线路板,向溶液中加入5.6 g铁粉,经充分反应后,溶液中还存在3.2g不溶物.下列说法正确的是( )
| A、3.2 g不溶物为铁、铜混合物 |
| B、加铁粉之前,溶液中存在的金属阳离子有Cu2+、Fe3+ |
| C、加铁粉之前,溶液中的c(Cu2+):c(Fe2+)=1:1 |
| D、反应结束后溶液中的c(Fe2+)=2 mol?L-1 |
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3?L-3,MgF2的Ksp为7.4×10-11mol3?L-3.下列说法中正确的是( )
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
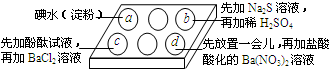 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )