题目内容
5.工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$.计算①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)?N2(g)+3H2(g)的平衡常数.
分析 设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,设转化的氮气为xmol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.60 1.60 0
转化 x 3x 2x
平衡 0.60-x 1.60-3x 2x
NH3的物质的量分数为$\frac{4}{7}$,则$\frac{2x}{0.60-x+1.60-3x+2x}$=$\frac{4}{7}$,
解得x=0.04mol,
结合转化率=$\frac{转化的量}{开始的量}$×100%、K为生成物浓度幂之积与反应物浓度幂之积的比、互为相反的两个反应的K互为倒数关系来计算..
解答 解:设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,设转化的氮气为xmol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.60 1.60 0
转化 x 3x 2x
平衡 0.60-x 1.60-3x 2x
NH3的物质的量分数为$\frac{4}{7}$,则$\frac{2x}{0.60-x+1.60-3x+2x}$=$\frac{4}{7}$,
解得x=0.4mol,
①该条件下N2的平衡转化率为$\frac{0.40mol}{0.60mol}$×100%=66.7%,
答:N2的平衡转化率为66.7%;
②N2(g)+3H2(g)?2NH3(g)的K=$\frac{(\frac{0.80mol}{2L})^{2}}{(\frac{0.4mol}{2L})^{3}×(\frac{0.2mol}{2L})}$=200,则该条件下反应2NH3(g)═N2(g)+3H2(g)的平衡常数为$\frac{1}{200}$=0.005,
答:2NH3(g)?N2(g)+3H2(g)的平衡常数为0.005.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及K的计算为解答的关键,侧重分析与计算能力的考查,注意物质的量分数的计算方法,题目难度不大.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g),△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),△H=-1160kJ•mol-1
下列说法正确的是( )
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
C(s)+H2O (g)?CO(g)+H2 (g),其化学平衡常数K和温度t的关系如表:
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)能判断该反应是否达到化学平衡状态的依据是abc.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(H2)
(3)某温度下,平衡浓度符合下式:c(CO)•c(H2)=c(H2O),试判断此时的温度为830℃;在此温度下,若反应开始时H2O (g)的浓度为a mol/L,当反应达到平衡时测得CO与H2的浓度均为0.2mol/L,则反应开始时H2O的浓度a=0.24 mol/L.
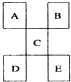
| A. | D一定足金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | E的原子序数一定是A的5倍,且原予半径比A大 | |
| D. | B的氢化物是以分子形式存在,且分子间存在氢键 |
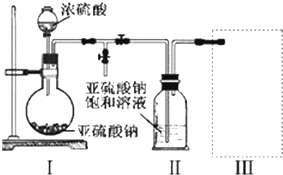

 如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:
如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题: