题目内容
10.设NA为阿伏加徳罗常数的值,下列叙述正确的是( )| A. | 1 mol ICl溶于NaOH溶液中生成NaC1和NaIO时,转移的电子数为NA | |
| B. | 常温下,1 L PH=2的HC1溶液和1 L PH=1的CH3COOH溶液混合后,混合溶液中所含的氢离子数目大于0.11NA | |
| C. | 常温下,含有NA个NO2和N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 常里常压下,18g D2O中所含中子数为10NA |
分析 A.ICl+2NaOH=NaC1+NaIO+H2O,此反应物元素价态发生变化,故不是氧化还原反应,故没有电子转移;
B.PH=2则c(H+)=0.01mol/L,1L的HC1溶液,则n1(H+)=0.01mol/L×1L=0.01mol,PH=1则c(H+)=0.1mol/L,1L的CH3COOH溶液,由于醋酸弱酸部分电离,溶液中有储备氢离子,则n2(H+)>0.1mol/L×1L=0.1mol,故n(H+)>n1(H+)+n2(H+)=0.01mol+0.1mol=0.11mol,据此进行分析;
C.NO2气体中存在平衡:2NO2?N2O4,正反应放热;
D.重水的相对分子质量为20,1个重水分子含有10个中子.
解答 解:A.ICl+2NaOH=NaC1+NaIO+H2O,此反应物元素价态发生变化,故不是氧化还原反应,故没有电子转移,故A错误;
B.PH=2则c(H+)=0.01mol/L,1L的HC1溶液,则n1(H+)=0.01mol/L×1L=0.01mol,PH=1则c(H+)=0.1mol/L,1L的CH3COOH溶液,由于醋酸弱酸部分电离,溶液中有储备氢离子,则n2(H+)>0.1mol/L×1L=0.1mol,故n(H+)>n1(H+)+n2(H+)=0.01mol+0.1mol=0.11mol,故混合溶液中所含的氢离子数目大于0.11NA,故B正确;
C.NO2气体中存在平衡:2NO2?N2O4,正反应放热,故将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,平衡右移,分子数小于NA个,则体积小于22.4L,故C错误;
D.18gD2O物质的量=$\frac{18g}{20g/mol}$=$\frac{9}{10}$mol,所含的中子数为$\frac{9}{10}$×(2+8)NA=9NA,故D错误,
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| B. | 氯化铝是强电解质,可电解其水溶液获得金属铝 | |
| C. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 | ||
| C. | 氨气极易溶于水 | D. | 甲醇的熔点 |
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |

| 选项 | 实验目的 | 解释 | |
| A | 图1 | 检验产物 | 错误,乙醇也能使高锰酸钾褪色 |
| B | 图2 | 配制银氨溶液 | 错误,只能制得沉淀 |
| C | 图3 | 比较醋酸、碳酸、苯酚酸性强弱 | 正确,可以发生预期现象 |
| D | 图4 | 制取乙酸乙酯并分离 | 正确,用氢氧化钠可以除去乙酸 |
| A. | A | B. | B | C. | C | D. | D |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3molH2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | 2 c1>c3 | B. | a1+a3<1 | C. | 2 p2<p1 | D. | a=b |

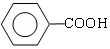
 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.