题目内容
13.关于实验,下列正误判断、解释均正确的是( )
| 选项 | 实验目的 | 解释 | |
| A | 图1 | 检验产物 | 错误,乙醇也能使高锰酸钾褪色 |
| B | 图2 | 配制银氨溶液 | 错误,只能制得沉淀 |
| C | 图3 | 比较醋酸、碳酸、苯酚酸性强弱 | 正确,可以发生预期现象 |
| D | 图4 | 制取乙酸乙酯并分离 | 正确,用氢氧化钠可以除去乙酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生成的乙烯中混有乙醇,二者都可被高锰酸钾氧化;
B.滴加氨水,先生成AgOH沉淀,继续反应可生成银氨络离子;
C.生成的二氧化碳中混有醋酸;
D.乙酸乙酯在氢氧化钠溶液中水解.
解答 解:A.因乙醇易挥发,则生成的乙烯中混有乙醇,二者都可被高锰酸钾氧化,不能用于检验乙烯,故A正确;
B.滴加氨水,先生成AgOH沉淀,继续反应可生成银氨络离子,故B错误;
C.因醋酸一挥发,生成的二氧化碳中混有醋酸,不能证明碳酸的酸性比比苯酚强,故C错误;
D.制备乙酸乙酯,应用碳酸钠溶液吸收,因乙酸乙酯在氢氧化钠溶液中水解,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,题目涉及物质的分离、检验等操作,侧重分析与实验能力的考查,注意实验的评价性和可行性的分析,题目难度不大.

练习册系列答案
相关题目
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
10.设NA为阿伏加徳罗常数的值,下列叙述正确的是( )
| A. | 1 mol ICl溶于NaOH溶液中生成NaC1和NaIO时,转移的电子数为NA | |
| B. | 常温下,1 L PH=2的HC1溶液和1 L PH=1的CH3COOH溶液混合后,混合溶液中所含的氢离子数目大于0.11NA | |
| C. | 常温下,含有NA个NO2和N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L | |
| D. | 常里常压下,18g D2O中所含中子数为10NA |
1.用NA表示阿伏德罗常数,下列叙述错误的是( )
| A. | 28gN2所含原子数为NA | B. | 0.5molH2O所含原子数为1.5NA | ||
| C. | 1molH2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
8.某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有SO42-离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L-1FeCl3溶液中,逐滴滴加1mo•L-1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.
18.除去酒精中混有的少量水,选用的试剂是( )
| A. | 金属钠 | B. | 浓H2SO4 | C. | 无水CaCl2 | D. | 生石灰 |
5.下列实验装置能达到相应目的是( )
| A. | 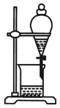 分离甘油和水 | B. | 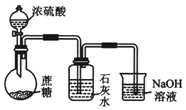 检验蔗糖与浓硫酸反应产生的CO2 | ||
| C. | 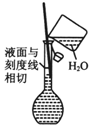 配制溶液 | D. | 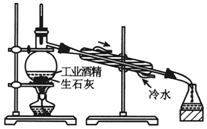 用工业酒精制取无水酒精 |
2.下列关于有机物的说法正确的是( )
| A. | 苯佐卡因( )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2 )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2 | |
| B. | 香叶醇( )能发生加成反应不能发生取代反应 )能发生加成反应不能发生取代反应 | |
| C. | 青蒿素( ) 的一氯代物有5种(不含立体异构) ) 的一氯代物有5种(不含立体异构) | |
| D. | 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种 |
3.我国医学家通过研究发现小苏打可去除肿瘤内的氢离子,从而快速有效地杀死处于葡萄糖饥饿或缺乏状态的肿瘤细胞,为治疗原发性肝癌开辟了新路径.下列有关小苏打的说法错误的是( )
| A. | 可用于制备苏打 | B. | 可用于糕点生产中 | ||
| C. | 与H+作用易产生CO2 | D. | 可用饱和食盐水与CO2反应制得 |