题目内容
20.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2为( )| A. | 7.5 mL | B. | 17.5 mL | C. | 25.0 mL | D. | 35.0 mL |
分析 一氧化氮与氧气的反应为4NO+3O2+2H2O═4HNO3,当试管内液面稳定在试管容积的一半,说明反应后剩余气体体积为10mL;剩余的气体可能为一氧化氮,有可能为氧气,分别根据反应方程式计算出两种情况下需要氧气的体积.
解答 解:当试管内液面稳定在试管容积的一半,说明反应后剩余气体体积为10mL,
由4NO+3O2+2H2O═4HNO3可知,若剩余10mL气体为NO,则氧气为(20mL-10mL)×$\frac{3}{4}$=7.5mL,
若剩余10mL气体为氧气,则20mLNO完全转化为硝酸,故氧气体积为:20mL×$\frac{3}{4}$+10mL=25mL,
故选AC.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后剩余气体组成为解答关键,注意掌握一氧化氮与氧气、水反应的总方程式及讨论法在化学计算中的应用.

练习册系列答案
相关题目
10.下列事实中不能用平衡移动原理解释的是( )
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业生产中,使用过量空气以提高SO2的利用率 | |
| D. | 合成氨反应采用催化剂以提高氨气的生产效率 |
8.下列各组物质中,一定属于同系物的是( )
| A. | 乙二醇和丙三醇 | B. | C6H5-OH和C6H5-CH2OH | ||
| C. | C2H4O和C4H8O | D. | C2H6和C10H22 |
15.下列物质属于电解质的是( )
| A. | 纯碱 | B. | 浓硫酸 | C. | 氯化钠溶液 | D. | 二氧化硫 |
5.下列叙述正确的是( )
| A. | 液氯能使鲜花褪色 | |
| B. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在实验室里,硅酸钠溶液存放在带磨口玻璃塞的试剂瓶中 |
12.已知Fe3O4可表示为(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,转移2 mol电子 | |
| C. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 |
10.有关下列装置的叙述不正确的是( )
| A. | 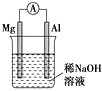 图铝片发生的电极反应式是:Al+4OH-3e-═AlO2-+2H2O | |
| B. |  图发生析氢腐蚀,离子反应方程式为:Fe+2H+═Fe2++H2↑ | |
| C. | 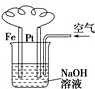 图溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3 | |
| D. | 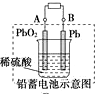 图充电时,阳极反应是:PbSO4+2H2O-2e-═=PbO2+SO42-+4H+ |
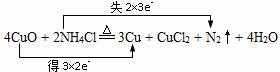 .
.