题目内容
19.提纯分离下述物质时,采用的方法与制取无水乙醇的方法相同的是( )| A. | 分离硬脂酸和甘油 | B. | 除去乙醛中少量醋酸 | ||
| C. | 分离苯酚和苯 | D. | 除去甲烷中少量乙烯 |
分析 实验室用蒸馏的方法制取无水乙醇,沸点不同的液体混合物,可用蒸馏的方法分离,以此解答该题.
解答 解:A.甘油易溶于水,可用盐析的方法分离,故A不选;
B.乙醛、乙酸都溶于水,但沸点不同,可用蒸馏的方法分离,故B选;
C.苯酚可与氢氧化钠溶液反应,而苯不溶于水,可用分液的方法分离,故C不选;
D.除去甲烷中少量乙烯,可通过溴水,用洗气的方法除杂,故D不选.
故选B.
点评 本题考查混合物的分离、提纯,为高频考点,明确常见混合物的分离方法及使用条件是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.A、B、C、D、E、F均为短周期主族元素,它们的原子序数依次增大,其中A的阴离子的核外电子数与B、C、D 原子的核外内层电子数相同.B的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产D的单质,E的原子序数为D的两倍.根据以上叙述,下列说法中正确的是( )
| A. | 上述六种元素的原子半径大小为A<B<C<D<F<E | |
| B. | A、B、D三种元素可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | A、B、C、F原子的核外最外层电子数的总和为18 | |
| D. | 由A与B组成的化合物的沸点一定低于由A与D组成的化合物的沸点 |
10.合成高分子材料因有优良的性能而大受欢迎,因此高分子材料合成是化学工业中的最重要产业.与一般金属材料相比,其优点是( )
| A. | 硬度高,热稳定性强 | B. | 耐热性好,耐磨性强 | ||
| C. | 导电性强,延展性好 | D. | 强度大,电绝缘性好 |
7.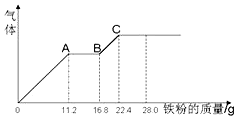 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原溶液中H2SO4浓度为4mol•L-1 | |
| B. | 图中,AB段的反应为2Fe3++Fe=3Fe2+,A点的溶质为Fe(NO3)3 | |
| C. | 原混合液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生是NO,BC段产生的气体是氢气 |
4.下列氧化还原反应所标出的电子转移情况中没有错误的是( )
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
11.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
8.下列事实不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 相对分子质量:Ar>K | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
9.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在,形成的单质是良好的半导体材料 | |
| B. | 单质常用作半导体材料和光导纤维 | |
| C. | 最高价氧化物是酸性氧化物,不能与酸反应 | |
| D. | 最高价氧化物对应的水化物的酸性比磷酸强 |
 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题: