题目内容
10.下列关于Na2O2的叙述正确的是( )| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
分析 A.Na2O2是淡黄色固体,易与空气中水、二氧化碳反应,最终生成Na2CO3白色固体;
B.过氧化钠与水反应中,过氧化钠中-1价的氧,部分化合价升高,部分化合价降低;
C.过氧化钠具有氧化性、漂白性;
D.依据过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:A.Na2O2是淡黄色固体,易与空气中水、二氧化碳反应,最终生成Na2CO3白色固体,故A错误;
B.过氧化钠与水反应中,过氧化钠中-1价的氧,部分化合价升高,部分化合价降低,过氧化钠既做氧化剂又做还原剂,故B错误;
C.过氧化钠具有氧化性,用Na2O2漂白过的织物、麦秆不会变黄,故C错误;
D.过氧化钠放入饱和NaOH溶液中,与水反应生成氢氧化钠和氧气,溶液为过饱和溶液,有氢氧化钠固体析出,故D正确;
故选:D.
点评 本题考查了元素化合物知识,明确过氧化钠的性质是解题关键,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
20.一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
18. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A. | a电极反应式是4OH--4e-═O2↑+2H2O | B. | b电极是阴极 | ||
| C. | 电解过程中水是氧化剂 | D. | b电极附近溶液的pH变大 |
5.现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol•L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | (m-0.1)g | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
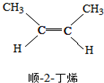
15.已知2-丁烯有顺、反两种同分异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.
 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
2.在一密闭容器中进行如下反应:A(g)+B(g)?2C(g)+2D,此反应符合图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是( )

| A. | 正反应为吸热反应,D是固体 | B. | 正反应为吸热反应,D是气体 | ||
| C. | 正反应为放热反应,D是固体或液体 | D. | 正反应为放热反应,D是气体 |
19.下列叙述正确的是( )
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 阳离子一定有氧化性,可能有还原性 | |
| C. | FeCl3溶液和Fe(OH)3胶体的共性是都能产生丁达尔效应 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
20.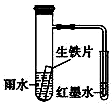 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 墨水液面回升时,碳电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.