题目内容
2.向Fe2O3和Fe组成的混合物中加入适量的稀H2SO4,各物质均恰好完全反应,测得所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2,那么反应中消耗Fe2O3、Fe、H2SO4物质的量之比为( )| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
分析 Fe和Fe2O3与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2;
依据反应Fe+2H+=Fe2++H2↑;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+2Fe3+=3Fe2+分析计算.
解答 解:Fe和Fe2O3与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2;
设生成氢气的物质的量为2a,则亚铁离子物质的量为5a
依据反应:Fe+H2SO4=Fe2++H2↑;
则有 2a 2a 2a 2a
Fe+2Fe3+=3Fe2+;
a 2a 3a
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
a 3a a
所以反应物中Fe2O3、Fe、H2SO4的物质的量之比=a:(a+2a):(2a+3a)=1:3:5;
故选D.
点评 本题考查了铁及其化合物的性质及计算,从方程式入手,根据Fe2+与H2的物质的量之比为4:1为突破口进行计算,题目较难.

练习册系列答案
相关题目
12.下列各组内的物质中互为同系物的是( )
| A. | CH3CH=CH2和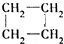 | B. | CH3CH2CH2CH3和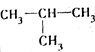 | C. | CH3Cl和CH3CH2Br | D. | CH3OH和CH3CH2OH |
13.下列颜色变化与氧化还原反应无关的是( )
| A. | 乙醇使酸性K2Cr2O7溶液由橙色变为绿色 | |
| B. | 向品红溶液中通入SO2气体,品红褪色,加热后又恢复红色 | |
| C. | 将铜丝在空气中烧黑后.趁热插入乙醇中又变红 | |
| D. | 将乙醛加人到新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
10.120mL含有0.20mol碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 1.2 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
7.正确书写离子方程式时,下列各项中,应使等式两边相等的是( )
①离子数目相等②粒子总数相等③原子数目相等④阳离子所带正电荷总数跟阴离子所带负电荷总数相等⑤分子数目相等⑥各元素原子数目相等.
①离子数目相等②粒子总数相等③原子数目相等④阳离子所带正电荷总数跟阴离子所带负电荷总数相等⑤分子数目相等⑥各元素原子数目相等.
| A. | 只有①⑤ | B. | 只有②④ | C. | 只有③⑥ | D. | 只有④⑥ |
14.将X气体通人BaCl2溶液中,未见沉淀生成.但若将X和SO2,同时通人BaCl2溶液中.就有沉淀生成.则X气体不可能是( )
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | NO2 |
15.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 滴加无色酚酞后仍为无色的溶液:Na+、CO32-、K+、ClO-、SO42- | |
| C. | 加入(NH4)2Fe(SO4)2•6H2O晶体的溶液中:Na+、H+、Cl-、NO3- | |
| D. | 常温下,pH<7的溶液中:I-、SO42-、Al3+、K+ |
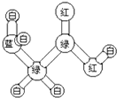 有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题:
有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: