题目内容
14.(1)有以下10种物质:①铁 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳⑦水银 ⑧氯化镁 ⑨硫酸钡=10 ⑩蔗糖.其中属于电解质的是③⑧⑨.
(2)写出⑧在水溶液中的电离方程式MgCl2=Mg2++2Cl-.
(3)写出①与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 (1)在水溶液或者熔融状态下能够导电的化合物是电解质;在水溶液和熔融状态下都不导电的化合物是非电解质;
(2)氯化镁为强电解质,完全电离;
(3)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气.
解答 解:(1)①铁是单质,不是电解质; ②稀硫酸是混合物不是电解质; ③氯化氢水溶液能够导电,是化合物,属于电解质; ④氨气本身不能电离,属于非电解质; ⑤空气是混合物,不是电解质; ⑥二氧化碳本身不能电离,属于非电解质;⑦水银是单质,不是电解质; ⑧氯化镁在水溶液或者熔融状态下能够导电的化合物是电解质; ⑨硫酸钡熔融状态下能够导电的化合物,属于电解质; ⑩蔗糖在水溶液和熔融状态下都不导电的化合物是非电解质;
所以属于电解质的是③⑧⑨;
故答案为:③⑧⑨;
(2)氯化镁为强电解质,完全电离,电离方程式:MgCl2=Mg2++2Cl-;
故答案为:MgCl2=Mg2++2Cl-;
(3)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,离子方程式:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查了电解质的判断、电离方程式、化学方程式的书写,明确电解质的概念及电解质电离方式是解题关键,注意单质和化合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.向Fe2O3和Fe组成的混合物中加入适量的稀H2SO4,各物质均恰好完全反应,测得所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为5:2,那么反应中消耗Fe2O3、Fe、H2SO4物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
6.铁及其化合物在日常生活中应用广泛.已知Fe(NO3)3•9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑(含有少量杂质Cu)与稀硝酸反应制备,主要流程如下:
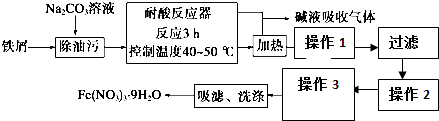
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.

| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.
4.用NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 7.8 g Na2O2与足量潮湿的CO2反应,转移的电子数为0.1 NA | |
| B. | 标准状况下2.24 L HCHO中含0.4 NA个原子 | |
| C. | 23.4g NaCl晶体中含0.1 NA个如图所示结构单元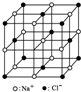 | |
| D. | 4.0gSiC晶体中含有的共价键数目为0.2NA |
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).