题目内容
20.A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题: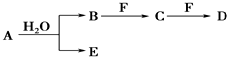
(1)若常温下A为有色气体.
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:Fe+4H++NO3-═Fe3++NO↑+2H2O.
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为
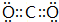 ;D中所含化学键的类型为离子键、共价键.
;D中所含化学键的类型为离子键、共价键.(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,请用离子方程式表示F的水溶液呈酸性的原因:Al3++3H2O?Al(OH)3+3H+.
(3)若A中一种元素原子的最外层电子数为内层电子总数的$\frac{1}{5}$,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;B转化为C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成.
(1)若常温下A为有色气体,
①当F是一种金属单质时,由转化关系可知,F为变价金属,B具有强氧化性,则A为NO2,B为HNO3,E为NO,F为Fe,C为Fe(NO3)3,D为Fe(NO3)2;
②A为有色气体,与水反应生成B与E,E具有漂白性,A为Cl2,B为HCl,E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为Na2CO3、C为CO2、D为NaHCO3;
(2)A为淡黄色固体,能与水反应,则A为Na2O2,D为白色难溶于水的物质,且A和D的相对分子质量相等,则B为NaOH,E为O2,F为铝盐,C为NaAlO2,D为Al(OH)3;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的$\frac{1}{5}$,则该元素原子有3个电子层,最外层电子数为2,该元素为Mg,B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,该盐为铵盐,A中含有氮元素,则A为Mg3N2,结合转化关系,可知B为NH3、F为O2、C为NO、D为HNO3,E为Mg(OH)2.
解答 解:A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成.
(1)若常温下A为有色气体.
①当F是一种金属单质时,由转化关系可知,F为变价金属,B具有强氧化性,则A为NO2,B为HNO3,E为NO,F为Fe,C为Fe(NO3)3,D为Fe(NO3)2,一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:Fe+4H++NO3-═Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
②A为有色气体,与水反应生成B与E,E具有漂白性,A为Cl2,B为HCl,E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为Na2CO3、C为CO2、D为NaHCO3,则C的电子式为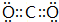 ,D中所含化学键的类型为离子键、共价键,
,D中所含化学键的类型为离子键、共价键,
故答案为: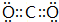 ;离子键、共价键;
;离子键、共价键;
(2)A为淡黄色固体,能与水反应,则A为Na2O2,D为白色难溶于水的物质,且A和D的相对分子质量相等,则B为NaOH,E为O2,F为铝盐,C为NaAlO2,D为Al(OH)3,用离子方程式表示物质F的水溶液呈酸性的原因为:Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的$\frac{1}{5}$,则该元素原子有3个电子层,最外层电子数为2,该元素为Mg,B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,该盐为铵盐,A中含有氮元素,则A为Mg3N2,结合转化关系,可知B为NH3、F为O2、C为NO、D为HNO3,E为Mg(OH)2.A与H2O反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,B转化为C的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物推断,基本属于猜测验证型题目,熟练掌握元素化合物的性质是关键,侧重考查学生对常见物质性质与特殊反应考查,难度中等.

| A. | CO2、O2 | B. | N2、CO | C. | Cl2、N2 | D. | H2S、SO2 |
| A. |  | B. |  | C. |  | D. |  |
| A. | H2O | B. | CCl4 | C. | NaOH(aq) | D. | H2SO4(浓) |
| A. | 150 mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L NH4Cl溶液 | ||
| C. | 75 mL 2 mol/L AlCl3溶液 | D. | 150 mL 1.5 mol/L MgCl2溶液 |
| A. | 77 | B. | 37 | C. | 191 | D. | 114 |
| A. | K3C60中只有离子键 | B. | K3C60中不含共价键 | ||
| C. | 该晶体在熔融状态下能导电 | D. | C60与12C互为同位素 |
 萨罗是一种消毒剂,它的分子式为C13H10O3,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等):
萨罗是一种消毒剂,它的分子式为C13H10O3,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等): .
.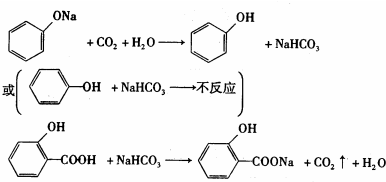
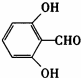 或
或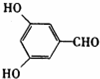 (任写一种).
(任写一种).