题目内容
10.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )| A. | K3C60中只有离子键 | B. | K3C60中不含共价键 | ||
| C. | 该晶体在熔融状态下能导电 | D. | C60与12C互为同位素 |
分析 K3C60为离子化合物,晶体中含有离子键和共价键,在熔融状态下能导电,结合同位素的概念解答该题.
解答 解:A.K3C60中中K+与C603-之间为离子键,C603-中C-C键为共价键,故A错误;
B.C603-中C-C键为共价键,故B错误;
C.K3C60为离子化合物,在熔融状态下能导电,故C正确;
D.C60为单质,12C为原子,而同位素为质子数相同中子数不同的原子,二者不属于同位素,故D错误.
故选C.
点评 本题考查晶体的知识,题目难度不大,解答本题关键是要把握离子化合物的组成,学习中注意同素异形体与同位素的关系.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
20.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1
I2(g)+H2(g)═2HI(g)△H=-9.4kJ•mol-1.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1
I2(g)+H2(g)═2HI(g)△H=-9.4kJ•mol-1.
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
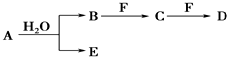
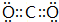 ;D中所含化学键的类型为离子键、共价键.
;D中所含化学键的类型为离子键、共价键.
 .
. 已知:1molC、1molCO分别按下式反应(燃烧):
已知:1molC、1molCO分别按下式反应(燃烧): .
. .
. 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).