题目内容
15.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是( )| A. | a=b | B. | 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) | ||
| C. | 混合溶液中,c(H+)=√Kw | D. | 混合溶液的pH=7 |
分析 A.一元酸和一元碱的相对强度不知;
B.在酸性、中性、碱性溶液中存在电荷守恒:c(H+)+c(B+)=c(OH-)+c(A-);
C.Kw=c(H+)×c(OH-),当c(H+)=$\sqrt{{K}_{w}}$,则c(H+)=c(OH-);
D.溶液的温度不知道,不能根据pH=7判断溶液的酸碱性.
解答 解:A.一元酸和一元碱的相对强度不知,因此无法判定得到的盐溶液的酸碱性,故A错误;
B.溶液中存在电荷守恒:c(H+)+c(B+)=c(OH-)+c(A-),酸性、碱性、中性溶液中均存在电荷守恒,故B错误;
C.Kw=c(H+)×c(OH-),当c(H+)=$\sqrt{{K}_{w}}$,则c(H+)=c(OH-),即溶液显中性,故C正确;
D.溶液的温度不知道,不能根据pH=7判断溶液的酸碱性,故D错误.
故选C.
点评 本题考查溶液的酸碱性的判断及电荷守恒的应用,题目难度不大,注意把握影响水的离子积的因素,在中性溶液中一定存在c(H+)=c(OH-).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列有关平衡常数的说法中不正确的是( )
| A. | 温度一定时,一个给定的化学反应的平衡常数是一个常数 | |
| B. | 改变反应物浓度或生成物浓度会改变平衡常数 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度Qc<K时,反应向正反应方向进行 |
3.下列关于环境问题的说法不正确的是( )
| A. | pH小于5.6的降雨称为酸雨 | |
| B. | 充分利用太阳能有助于“节能减排” | |
| C. | 在燃煤中加入适量石灰石,有助于环境保护 | |
| D. | 含磷洗涤剂易被细菌分解,不会导致水体污染 |
10.下列物质敞口露置于空气中,质量不变的是( )
| A. | 氢氧化钙 | B. | 氯化钠 | C. | 生石灰 | D. | 浓盐酸 |
5.下列化学实验的操作不正确的是( )
| A. | 给烧瓶加热时,要垫上石棉网 | |
| B. | 给试管里的液体加热,液体体积不超过试管容积的三分之一 | |
| C. | 用托盘天平称量氢氧化钠固体时,应该放在小烧杯里称量 | |
| D. | 酒精灯打翻用水扑灭 |
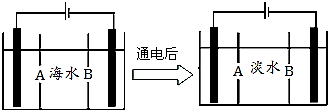 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水. X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.