题目内容
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、在常温常压下,2.8 gN2和CO的混合气体所含电子数为1.4NA | ||
| B、标准状况下,22.4 LCCl4含有的分子数目为NA | ||
C、1 L O.1 mol?L-1NaHCO3溶液中含有0.1NA个HCO
| ||
| D、在电解精炼粗铜的过程中,当转移电子数为 NA时,阳极溶解32 g |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氮气和CO的摩尔质量都是28g/mol,二者都含有14个电子,2.8g该混合物中的物质的量为0.1mol,含有1.4mol电子;
B.气体摩尔体积适用对象为气体;
C.碳酸氢根为多元弱酸的酸式根离子,存在水解和电离;
D.电解精炼过程粗铜做阳极,杂质铁、锌、镍等通电时也失电子,依据电解过程中电子守恒分析.
B.气体摩尔体积适用对象为气体;
C.碳酸氢根为多元弱酸的酸式根离子,存在水解和电离;
D.电解精炼过程粗铜做阳极,杂质铁、锌、镍等通电时也失电子,依据电解过程中电子守恒分析.
解答:
解:A.N2和CO的摩尔质量都是28g/mol,氮气和NO分子中都含有14个电子,2.8g该混合物中的物质的量为0.1mol,含有1.4mol电子,所含电子数为1.4NA,故A正确;
B.标况下,CCl4为液态,不能使用气体摩尔体积,故B错误;
C.因为碳酸氢根为多元弱酸的酸式根离子,存在水解和电离,所有1 L O.1 mol?L-1NaHCO3溶液中含有小于0.1NA个HCO3-,故C错误;
D.电解精炼铜的过程中转移了NA个电子,阳极溶解失电子的有铜、铁、锌、镍等,依据电子守恒阳极溶解铜的质量不等于32g,故D错误;
故选:A.
B.标况下,CCl4为液态,不能使用气体摩尔体积,故B错误;
C.因为碳酸氢根为多元弱酸的酸式根离子,存在水解和电离,所有1 L O.1 mol?L-1NaHCO3溶液中含有小于0.1NA个HCO3-,故C错误;
D.电解精炼铜的过程中转移了NA个电子,阳极溶解失电子的有铜、铁、锌、镍等,依据电子守恒阳极溶解铜的质量不等于32g,故D错误;
故选:A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查了酸式根离子的电离和水解的应用,电解精炼原理应用,物质组成的分析判断,气体摩尔体积的条件应用,题目难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
在Na2O2与CO2 的反应中,下列说法正确的是( )
| A、该反应中Na2O2 是氧化剂,CO2 是还原剂 |
| B、1mol Na2O2参加反应,有2mole-转移 |
| C、Na2O2晶体中阴阳离子个数比为1:2 |
| D、CO2分子中含有极性键和非极性键 |
氨氧化制硝酸时.在吸收塔发生如下反应:3N〇2(g)+H2O(l)?2HNO3+NO(g),△H<0,为加快此反应的反应速率,下列措施不可行的是( )
| A、降低温度 |
| B、升高温度 |
| C、再加人NO2 |
| D、增大吸收塔中的压强 |
下列是一些化学键的键能:
根据键能数据估算:CH4 (g)+4F2 (g)=CF4(g)+4HF(g),该反应每生成1molHF(g)( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ?mol-1) | 414 | 489 | 565 | 155 |
| A、放热485 kJ |
| B、吸热485 kJ |
| C、放热1940 kJ |
| D、吸热1940 kJ |
下列离子方程式表达正确的是( )
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、向1mol/L 的AlCl3 溶液中加入过量的稀氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、向稀NH4HCO3 溶液中滴加过量NaOH溶液:NH4++OH-=NH3?H2O |
| D、向C6H5ONa溶液中通入适量CO2:C6H5O-+CO2+H2O=C6H5OH+HCO3- |
黏土和石灰石高温煅烧后再加入适量的石膏磨成细粉,所得的产品是( )
①水泥②玻璃③瓷器④混凝土⑤一种硅酸盐.
①水泥②玻璃③瓷器④混凝土⑤一种硅酸盐.
| A、①② | B、①⑤ | C、③ | D、② |
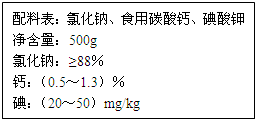 由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题: