题目内容
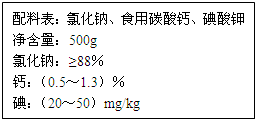 由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:(1)标签上“碘:(20~50)mg/kg”中的“碘”是指
A.元素 B.分子 C.原子 D.单质
(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是
(3)为了测定此盐的钙元素含量,取20g此盐溶于水,加入10mL盐酸使其完全反应,生成CO2气体134.4mL(标准状况下).则此加钙食盐中钙元素的质量分数为
考点:微量元素对人体健康的重要作用,元素,元素质量分数的计算
专题:
分析:(1)根据加碘食盐的碘以离子形态存在,不能以单质、分子、原子形式存在,所以加碘食盐的碘是指碘元素;
(2)根据醋酸和碳酸钙发生反应可产生气体这一明显现象考虑;
(2)根据二氧化碳的体积计算出碳酸钙的质量,再计算出钙元素的质量,然后用食盐中钙元素的质量分数=
×100%进行计算;根据方程式求氯化氢的物质的量.
(2)根据醋酸和碳酸钙发生反应可产生气体这一明显现象考虑;
(2)根据二氧化碳的体积计算出碳酸钙的质量,再计算出钙元素的质量,然后用食盐中钙元素的质量分数=
| 食盐中碳酸钙的质量 |
| 食盐的质量 |
解答:
解:(1)根据加碘食盐的碘以离子形态存在,不能以单质、分子、原子形式存在,所以加碘食盐的碘是指碘元素;
故选:A;
(2)醋的主要成分是CH3COOH,它和碳酸钙发生化学反应,有气体产生,故答案为:醋;
(3)134.4mLCO2气体的物质的量为
moL=0.006moL,设生成0.006moL二氧化碳需要碳酸钙质量为X,则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100g 1moL
X 0.006moL
=
,解得X=0.6g,所以钙元素质量为0.6mg×40%=0.24g,20g此食盐中含钙量为:
×100%=1.2%,
盐酸中氯化氢的物质的量为0.012moL,盐酸的物质的量浓度为
=1.2mol/L
故答案为:1.2%;1.2mol/L.
故选:A;
(2)醋的主要成分是CH3COOH,它和碳酸钙发生化学反应,有气体产生,故答案为:醋;
(3)134.4mLCO2气体的物质的量为
| 0.1344 |
| 22.4 |
CaCO3+2HCl═CaCl2+H2O+CO2↑
100g 1moL
X 0.006moL
| 100g |
| X |
| 1moL |
| 0.006moL |
| 0.24g |
| 20g |
盐酸中氯化氢的物质的量为0.012moL,盐酸的物质的量浓度为
| 0.012moL |
| 0.01L |
故答案为:1.2%;1.2mol/L.
点评:本题考查元素质量分数的计算,元素的概念,碳酸盐的鉴别方法,注意有关方程式的计算是解题的难点,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
A、 的分子式为C17H24O3 的分子式为C17H24O3 |
| B、水溶液中氨基酸在等电点时的溶解度最小.不同的氨基酸达到等电点的pH不同,故可以通过调节溶液pH分离某些氨基酸 |
C、有机硅聚醚( )可由单体 )可由单体  和 和 缩聚而成 缩聚而成 |
| D、等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
下列所描述的现象与氧化还原反应有关的是( )
| A、银白色的钠放置于空气中变暗 |
| B、白色的CuSO4粉末遇水变蓝 |
| C、Na2CO3溶液中加入CaCl2溶液产生白色沉淀 |
| D、活性炭使红墨水褪色 |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、明矾净水和家用消毒剂的消毒原理相同 |
| B、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| C、铝合金的广泛使用是因为人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、钒氮合金钢是“鸟巢”的主要材料之一,其熔点、硬度和强度均高于纯铁 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、在常温常压下,2.8 gN2和CO的混合气体所含电子数为1.4NA | ||
| B、标准状况下,22.4 LCCl4含有的分子数目为NA | ||
C、1 L O.1 mol?L-1NaHCO3溶液中含有0.1NA个HCO
| ||
| D、在电解精炼粗铜的过程中,当转移电子数为 NA时,阳极溶解32 g |

 b.
b. c.
c. d.
d.