��Ŀ����
19����Է�������Ϊ92��ij������X��һ����Ҫ���л�����ԭ�ϣ��о���������Ϊ��ʼԭ����Ƴ�����ת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ��������A��һ�ȴ��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO��
��֪��

�������ѧ֪ʶ�뱾��������Ϣ�ش��������⣺
��1��X�ķ���ʽ��C7H8��
��2��H�Ľṹ��ʽ��
 ��
����3����Ӧ�ڡ��ܵ�������������Ӧ�����۷�Ӧ��
��4����Ӧ�ݵĻ�ѧ����ʽ��
 ��
����5��
 �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ��
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ��6�֣�
��6�����úϳɷ�Ӧ����ͼ��ʾ����A����������ܼ���ѡ���ϳ�
 ������ķ�����
������ķ�����ʾ����ͼ��

���� ��Է�������Ϊ92��ij������X��һ����Ҫ���л�����ԭ�ϣ���������ΪCxHy���� $\frac{92}{12}$=7��8����������Cԭ����Hԭ�ӹ�ϵ��֪��������Cԭ����Ŀ����С��7���ʸ÷�����X�ķ���ʽΪC7H8���ṹ��ʽΪ ��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ
��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ ��BΪ
��BΪ ��CΪ
��CΪ ��D�ữ����E����DΪ
��D�ữ����E����DΪ ��EΪ
��EΪ ��
�� ��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ
��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ ��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ
��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ ��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO����
��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO����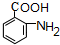 �ķ���ʽ��ȼ���1����H2O��Ϊ
�ķ���ʽ��ȼ���1����H2O��Ϊ ͨ���γ��ļ��������۷�Ӧ�Ǵ��ĸ߾��HΪ
ͨ���γ��ļ��������۷�Ӧ�Ǵ��ĸ߾��HΪ ��
��
�ɷ�Ӧ��������Ľṹ��֪����Ӧ���ǵĻ�ѧ����ʽ�� ��������������Ӧ����
��������������Ӧ���� ��
��
��6��1-�ȼױ������������ӳɷ�Ӧ���� ��
�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ��
�� ����ȡ����Ӧ����
����ȡ����Ӧ���� ��
�� ����ȡ����Ӧ����
����ȡ����Ӧ���� ��
��
��� �⣺��Է�������Ϊ92��ij������X��һ����Ҫ���л�����ԭ�ϣ���������ΪCxHy���� $\frac{92}{12}$=7��8����������Cԭ����Hԭ�ӹ�ϵ��֪��������Cԭ����Ŀ����С��7���ʸ÷�����X�ķ���ʽΪC7H8���ṹ��ʽΪ ��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ
��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ ��BΪ
��BΪ ��CΪ
��CΪ ��D�ữ����E����DΪ
��D�ữ����E����DΪ ��EΪ
��EΪ ��
�� ��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ
��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ ��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ
��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ ��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO����
��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO���� �ķ���ʽ��ȼ���1����H2O��Ϊ
�ķ���ʽ��ȼ���1����H2O��Ϊ ͨ���γ��ļ��������۷�Ӧ�Ǵ��ĸ߾��HΪ
ͨ���γ��ļ��������۷�Ӧ�Ǵ��ĸ߾��HΪ ��
��
�ɷ�Ӧ��������Ľṹ��֪����Ӧ���ǵĻ�ѧ����ʽ�� ��������������Ӧ����
��������������Ӧ���� ��
��
��1��X�Ǽױ��������ʽΪC7H8���ʴ�Ϊ��C7H8��
��2��H�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3����Ӧ�ڡ��ܵ������Ƿֱ���������Ӧ�����۷�Ӧ���ʴ�Ϊ��������Ӧ�����۷�Ӧ��
��4���÷�ӦΪ����ȩ��������Ӧ����Ӧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��5�� ��ͬ���칹�������������������1��ȩ����2���ǻ������ڷ����廯�����������ǻ�λ����λ��2�ֽṹ����������ǻ�λ�ڼ�λ3�ֽṹ����������ǻ�λ�ڶ�λ��1�ֽṹ���������������6�֣�
��ͬ���칹�������������������1��ȩ����2���ǻ������ڷ����廯�����������ǻ�λ����λ��2�ֽṹ����������ǻ�λ�ڼ�λ3�ֽṹ����������ǻ�λ�ڶ�λ��1�ֽṹ���������������6�֣�
�ʴ�Ϊ��6��
��6��1-�ȼױ������������ӳɷ�Ӧ���� ��
�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ��
�� ����ȡ����Ӧ����
����ȡ����Ӧ���� ��
�� ����ȡ����Ӧ����
����ȡ����Ӧ���� ����ϳ�·��Ϊ
����ϳ�·��Ϊ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л��ƶϺ��л��ϳɣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶϼ���ȡ��Ϣ������Ϣ��������������ϳ�·�������������ȷ�л�������ż������ʹ�ϵ������֮���ת������Ӧ���ͼ���Ӧ�����ǽⱾ��ؼ����ѵ��Ǻϳ�·����ƣ���Ŀ�Ѷ��еȣ�

| A�� | һ���¶ȡ�ѹǿ�£�һ���������κ����ʵ�����������ƽ������������ | |
| B�� | ����������һ���ǽ�����������������ﲻһ���Ǽ��������� | |
| C�� | ���ݻ������к�����Ŀ�Ķ��٣��ѻ������ΪһԪ�ᡢ��Ԫ�ᡢ��Ԫ��� | |
| D�� | ǿ�������Һ�ĵ�������һ��ǿ�����������Һ�ĵ������� |
| A�� | �����������������ȡ����Ӧ�����ò���ֻ��һ�� | |
| B�� | ����ˮ������ղ���һ���������� | |
| C�� | ���ۺ���ά�ص���ɶ������ã�C6H10O5��n��ʾ���������Ǽ���ͬϵ������ͬ���칹�� | |
| D�� | ��֬��ʳ������е���Ҫ���֣�Ҳ�Dz���������ߵ�Ӫ������ |
 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ������1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230�����������ת�����ɼ״�������ˮ������ͼ��ʾ��ѹ������0.5mol CO2��1.5mol H2ת���ʴ�80%ʱ�������仯ʾ��ͼ��
��д���÷�Ӧ���Ȼ�ѧ����ʽ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49 kJ•mol-1��
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������bd��
a��������ѹǿ����
b��H2�������������
c��c��H2��=3c��CH3OH��
d���������ܶȲ���
e��2��C=O���ѵ�ͬʱ��6��H-H���ѣ�
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ�����������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
����ʵ��3�У���ƽ��ʱCOת���ʴ���ˮ����ת���ʣ���a/b ��ֵ0��$\frac{a}{b}$��1�������ֵ��Χ����
����ʵ��4�У�������990�棬�ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱV����V�������������=��������
��3����֪�ڳ����£��״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ•mol-1
��H2O��g���TH2O��l����H3=-44.0kJ•mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽCH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ/mol��
��4����֪������һ�ֶ�Ԫ�ᣬ����������Һ�����ԣ���������10Ml0.01mol/LH2C2O4��Һ�еμ�10mL0.01mol/LNaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȴ�С��ϵc��Na+����c��HC2O4-����c��H+����c��C2O42-����c��OH-��
��5���Լ��ѿ�������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ�صĸ�����ӦʽΪCH3OCH3+16OH--12e-=2CO32-+11H2O��


 ��֪�й��Ȼ�ѧ����ʽΪ����4NH3��g��+5O2��g��4NO��g��+6H2O��g����H=-905kJ/mol����3H2��g��+N2��g��2NH3��g����H=-92.4kJ/mol����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol����N2��g��+O2��g��=2NO��g����H=QkJ/mol����Ӧ�����йػ�ѧ���ļ��ܣ�kJ/mol�����£�H-O��463��H-N��391��O=O��497
��֪�й��Ȼ�ѧ����ʽΪ����4NH3��g��+5O2��g��4NO��g��+6H2O��g����H=-905kJ/mol����3H2��g��+N2��g��2NH3��g����H=-92.4kJ/mol����2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol����N2��g��+O2��g��=2NO��g����H=QkJ/mol����Ӧ�����йػ�ѧ���ļ��ܣ�kJ/mol�����£�H-O��463��H-N��391��O=O��497