题目内容
10.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙和一种氮肥.请根据要求答问题:(1)写出该反应的化学方程式CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(2)如何判断所得碳酸钙是否为纳米级取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
分析 (1)根据二氧化碳和氨气的溶解性判断先通入的气体,由反应物和生成物写出反应方程式;
(2)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以根据胶体的性质确定实验方法.
解答 解:(1)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
故答案为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(2)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以具有胶体的性质,运用胶体的丁达尔效应判断,方法为取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,
故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
点评 本题考查了化学方程式的书写,胶体的判断,明确反应实质及胶体的性质是解题关键,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质解题,题目难度不大.

练习册系列答案
相关题目
20. 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
回答下列问题:
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
1. 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm~3cm;
E.调节液面至“0”或“0”以下刻度并记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度.
据此实验完成填空:
(1)正确操作步骤的顺序是B、D、C、E、A、F(用序号字母填写).
(2)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是偏高.
(4)判断到达滴定终点的实验现象是滴入最后一滴NaOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
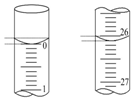
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL.
(6)某学生根据三次实验分别记录有关数据如上:请选用其中合理的数据列式计算该盐酸溶液的物质的量浓度:c(HCl)=0.1044mol/L.
 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:A.量取25.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm~3cm;
E.调节液面至“0”或“0”以下刻度并记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度.
据此实验完成填空:
(1)正确操作步骤的顺序是B、D、C、E、A、F(用序号字母填写).
(2)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是偏高.
| 滴定 次数 | 盐酸溶液/mL | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前 | 滴定 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL.
(6)某学生根据三次实验分别记录有关数据如上:请选用其中合理的数据列式计算该盐酸溶液的物质的量浓度:c(HCl)=0.1044mol/L.
15.下列除杂质的操作方法不正确的是( )
| A. | 三氧化二铁中有少量的氧化铝:加过量的烧碱溶液后过滤洗涤 | |
| B. | 氯化钠中有少量的I2:通过加热的方法 | |
| C. | CO中有少量的CO2:用氢氧化钠洗涤后再干燥 | |
| D. | 食盐中有少量的氧化铝:加过量的烧碱溶液后蒸发结晶 |
2.下列物质的提纯(括号内为杂质),所选试剂和仪器正确的组合是( )
①Fe2O3(Al2O3):盐酸 ②H2O(I2):酒精 ③Na2CO3(NaHCO3):石灰水 ④豆油(水):不需试剂

①Fe2O3(Al2O3):盐酸 ②H2O(I2):酒精 ③Na2CO3(NaHCO3):石灰水 ④豆油(水):不需试剂

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
19.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: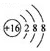 | |
| B. | 原子核内有10个质子的氧原子${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: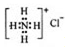 | |
| D. | 邻氯甲苯的结构简式: |



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案.
最合理的方案.