题目内容
10.已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核、10个电子的分子.试回答下列问题:(1)写出五种元素的符号:ANa,BO,CS,DN,EH.
(2)D形成的单质的化学式是N≡N,B、D、E形成的离子化合物的化学式是NH4NO3,离子化合物A3D的电子式是
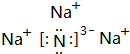 .
.
分析 A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素,据此解答.
解答 解:A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素,
(1)由上述分析可知,A为Na,B为O,C为S,D为N,E为H,
故答案为:Na;O;S;N;H;
(2)D为N元素,形成单质为N2,结构式为N≡N,B、D、E形成的离子化合物的化学式是NH4NO3,离子化合物Na3N的电子式是: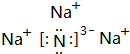 ,
,
故答案为:N≡N;NH4NO3;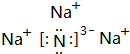 .
.
点评 本题考查结构与位置关系、元素化合物推断等,难度中等,推断元素是解题关键,注意掌握电子式的书写、常见10电子微粒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
3.有一处于平衡状态的反应A(g)+3B(g)?2C(g);△H<0,为了使平衡向生成C的方向移动,应选择的条件是( )
| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
20.下列有机物命名正确的是( )
| A. |  2-甲基丁烷 2-甲基丁烷 | B. |  间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-羟基丁烷 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
1.下列各组离子在溶液中能够大量共存的是( )
| A. | H+、Fe2+、Na+、ClO- | B. | Cu2+、Ba2+、OH-、Cl- | ||
| C. | Ca2+、K+、Al3+、CO32- | D. | NH4+、NO3-、Na+、SO42- |

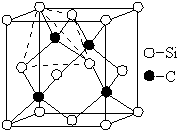 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题: