题目内容
9.A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
| A. | A>B>D>C | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
分析 活泼性较强的金属作原电池的负极,易失去电子而被氧化;原电池中电子从负极流经外电路流向正极,电流从正极沿外电路流向负极;原电池正极上得电子生成气体或析出单质,以此可确定金属的活泼性强弱.
解答 解:①活泼性较强的金属作原电池的负极,A、B用导线相连后,同时插入稀H2SO4中,A极为负极,则活泼性:A>B;
②C、D用导线相连后,同时浸入稀硫酸中,电子由负极→导线→正极,电流方向与电子方向相反,电流由正极C→导线→负极D,则活泼性D>C;
③A、C相连后,同时浸入稀硫酸中,C极产生大量气泡,说明C为原电池的正极,较不活泼,则活泼性:A>C;
④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应,说明B为原电池的负极,则活泼性B>D;
所以有:A>B>D>C,
故选A.
点评 本题考查金属活泼性的比较,侧重于学生的分析能力的考查,题目难度不大,本题注意把握如何从原电池的角度比较金属的活泼性,原电池中,较为活泼的金属作负极

练习册系列答案
相关题目
19.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
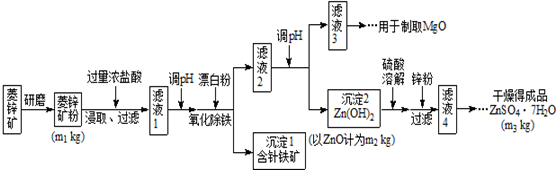
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□ClO-+□H2O═□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH≤10.4.
(5)工业上从“滤液3”制取MgO过程中,最合适的反应物是B(选填序号).K^S*5U.C#O%
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□ClO-+□H2O═□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH≤10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.
20.硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,分别进行了四组实验,数据记录如下,出现沉淀所需时间最短的是( )
| 温度(℃) | Na2S2O3溶液 | H2SO4溶液 | H2O的体积 | 出现沉淀所需时间 | |||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| A | 0 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| B | 0 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| C | 30 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| D | 30 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| A. | A | B. | B | C. | C | D. | D |
17.下列说法不正确的是( )


| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔沸点由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 沸点由高到低:HI>HBr>HCl>HF | |
| D. | 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2 |
4.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
14.下列说法不正确的是( )
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质分子的粒子之间不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 阴、阳离子间通过离子键一定能形成离子化合物 |
18.已知:X2(g)+Y2(g)?2Z(g),X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1.在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
| A. | Z为0.4mol•L-1 | B. | X2为0.2 mol•L-1 | C. | Y2为0.4 mol•L-1 | D. | Z为0.3 mol•L-1 |
19.下列分子式表示的有机物中,含单官能团的同分异构体数目最多的是( )
| A. | C4H8 | B. | C4H7Cl | C. | C4H8O | D. | C4H10O |
