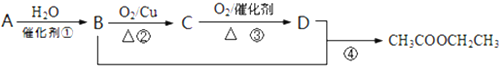
题目内容
14.垃圾是放错地方的资源,工业废料也可以再利用.某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3).实验方案如下: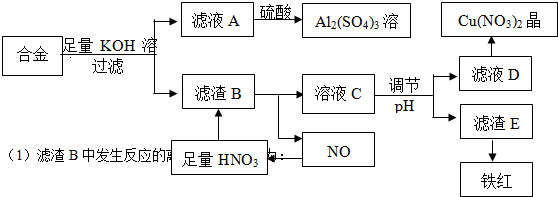
(1)滤渣B中发生反应的离子反应方程式为:2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,NO3-+Fe+4H+=Fe3++NO↑+2H2O;
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中可用作调整溶液C的pH的试剂是CD(填序号).
A、铜粉B、氨水C、氢氧化铜D、碱式碳酸铜
(3)常温,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8mol/L,此时Cu(OH)2无沉淀生成(填“有”或“无”).
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O.
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol•L-1,c(H2SO4)=3mol•L-1,将0.3mol的铜放入加热充分反应后,被还原的HNO3的物质的量为0.2mol.
分析 合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,滤液A中加入硫酸得到硫酸铝溶液,滤渣中加入足量的硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,通过调节溶液pH,使铁离子转化为氢氧化铁沉淀,过滤分离,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,氢氧化铁加热分解得到铁红.
(1)Cu与硝酸反应得到硝酸铜、NO与水,Fe与足量的硝酸反应生成硝酸铁、NO与水;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(3)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe3+);计算浓度积Qc与Ksp[Cu(OH)2]比较判断;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,钡离子与硫酸根结合为硫酸钡沉淀,硫酸根完全反应,铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,结合原子守恒、电荷守恒配平;
(5)根据反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O进行过量计算解答.
解答 解:合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,滤液A中加入硫酸得到硫酸铝溶液,滤渣中加入足量的硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,通过调节溶液pH,使铁离子转化为氢氧化铁沉淀,过滤分离,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,氢氧化铁加热分解得到铁红.
(1)Cu与硝酸反应得到硝酸铜、NO与水,反应离子方程式为:2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,
Fe与足量的硝酸反应生成硝酸铁、NO与水,反应离子方程式为:NO3-+Fe+4H+=Fe3++NO↑+2H2O,
故答案为:2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,NO3-+Fe+4H+=Fe3++NO↑+2H2O;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,
故答案为:CD;
(3)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
溶液中氢氧根离子的浓度为10-10mol/L,则浓度积Qc=c(Cu2+)×c2(OH-)=1×(10-10)2=10-20<Ksp[Cu(OH)2]=2.2×10-20,所以没有氢氧化铜沉淀生成;
故答案:4.0×10-8mol/L;无;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,钡离子与硫酸根结合为硫酸钡沉淀,硫酸根完全反应,铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,结合原子守恒、电荷守恒配平离子方程式为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O,
故答案为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O;
(5)n(HNO3)=0.1L×2mol/L=0.2mol,n(H2SO4)=0.1L×3mol/L=0.3mol,
则n(H+)=0.2mol+2×0.3mol=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,
3 Cu+8 H++2 NO3-=3Cu2++2NO↑+4H2O
3 8 2
0.3mol 0.8mol 0.2mol
恰好完全反应,故0.2molNO3-完全被还原;
故答案为:0.2mol.
点评 本题主要考查了物质的分离提纯和制备,题目涉及离子反应方程式的书写、除杂质、氧化还原反应、溶度积的有关计算等,综合性较强,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
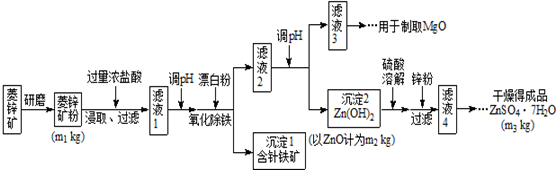
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□ClO-+□H2O═□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH≤10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.
| A. | 直链烷烃中,碳原子数越多沸点越高 | |
| B. | 碳原子数相同的烷烃,支链越多沸点越高 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃 | |
| D. | 碳原子数相同的醇,羟基越多沸点越高 |
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |

 ,其原子核外共有22种运动状态不相同的电子.
,其原子核外共有22种运动状态不相同的电子.