题目内容
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 足量铜与含硝酸4 mol 的浓硝酸反应,生成氮的氧化物中氮的化合价为+4 价 | |
| C. | 1 mol 铜与足量浓硝酸反应,生成标况下气体体积为44.8 L | |
| D. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA |
分析 A、双氧水分解制取氧气时,氧元素的价态由-1价变为0价;
B、铜和浓硝酸反应生成二氧化氮,和稀硝酸反应生成NO;
C、铜和浓硝酸反应生成NO2,设生成的NO2的物质的量为xmol,根据得失电子数守恒分析;然后根据NO2中存在平衡:2NO2?N2O4来分析;
D、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2molN原子来分析.
解答 解:A、双氧水分解制取氧气时,氧元素的价态由-1价变为0价,故若制得标况下1.12L氧气即0.05mol氧气时,转移0.1mol电子即0.1NA个,故A错误;
B、铜和浓硝酸反应生成二氧化氮,随着硝酸变稀,铜和稀硝酸反应生成NO,故生成的产物中氮元素的价态并不全是+4价,故B错误;
C、铜和浓硝酸反应生成NO2,设生成的NO2的物质的量为xmol,根据得失电子数守恒可知:1mol×2=xmol×1,解得x=2mol;而NO2中存在平衡:2NO2?N2O4,导致气体的物质的量小于2mol,则在标况下的体积小于44.8L,故C错误;
D、溶液中硝酸铵的物质的量n=CV=0.5mol/L×1L=0.5mol,而1mol硝酸铵中含2molN原子,故0.5mol硝酸铵中含NA个氮原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列物质晶体结构中含有正四面体结构的化合物是( )
| A. | SiO2 | B. | 金刚石 | C. | KCl | D. | 干冰 |
1.表是A、B、C、D、E五种有机物的有关信息.
(1)A~E中,属于烃的是AB(填字母).
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 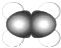 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型为 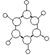 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O(用化学方程式说明).
18.按要求选用合适的试剂或操作完成下列的鉴别、分离或除杂.
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | 紫色石蕊试液(Na2CO3溶液、NaHCO3溶液) |
| 鉴别棉花和蚕丝 | 灼烧 |
| 除去乙烷中混有的乙烯 | 溴水(溴的CCl4溶液) |
| 除去苯中溶解的溴单质 | NaOH溶液 |
| 海水淡化 | 蒸馏 |
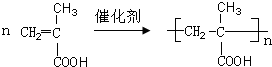
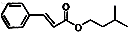 )是一种香料,一种合成路线如图:
)是一种香料,一种合成路线如图:
 ;
;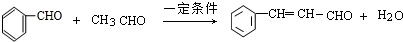 .
.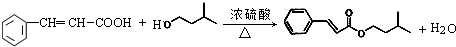 ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.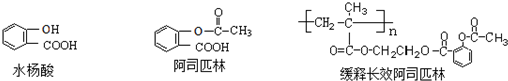
 .
. ;
; .
.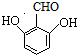 、
、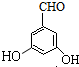 、
、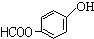 (任写一个).
(任写一个).
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.