题目内容
15. 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.(1)化学反应中的能量变化,通常主要表现为热量的变化.
①下列反应中,属于放热反应的是c(填序号).
a. Ba(OH)2•8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如图1所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.
(2)电能是现代社会应用最广泛的能源之一.
图2所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出标准状况下气体2.24L,电路中通过的电子数为0.2NA.
分析 (1)①根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应;
②中和反应是放热反应;
(2)根据金属的活泼性和原电池原理分析,锌做负极被氧化,铜做正极溶液中氢离子得到电子发生还原反应生成氢气,根据消耗的金属的量和电极反应中电子守恒计算;
解答 解:(1)①a、Ba(OH)2•8H2O与NH4Cl混合搅拌属于常见的吸热反应,故a错误;
B、碳酸钙高温分解成氧化钙和二氧化碳的反应是吸热反应,故b错误;
碳与水蒸气生成一氧化碳和氢气是常见的吸热反应,故B错误;
C、铝与盐酸反应,发生置换反应,属于氧化还原反应,反应过程中放热,故c正确;
故答案为:c;
②中和反应是放热反应,离子方程式为H++OH-=H2O,故答案为:放热;H++OH-=H2O;
(2)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,物质的量n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol
总反应:Zn+2H+=H2↑+Zn2+
1 1
0.1mol 0.1mol
则放出标准状况下气体体积=0.1mol×22.4L/mol=2.24L,
Zn-2e-=Zn2+,电路中通过的电子数为0.2NA,
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;2.24;0.2NA;
点评 本题以原电池为载体考查了氧化还原反应的有关计算、原电池原理和电极反应,明确各物理量之间的关系和原电池原理是解本题的关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | CH≡CH和CH2═CH-CH═CH2 | B. | CH3-CH═CH2和CH3-CH2-CH═CH2 | ||
| C. | CH3-CH3和CH3-CH═CH2 | D. | 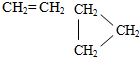 |
| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 足量铜与含硝酸4 mol 的浓硝酸反应,生成氮的氧化物中氮的化合价为+4 价 | |
| C. | 1 mol 铜与足量浓硝酸反应,生成标况下气体体积为44.8 L | |
| D. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA |
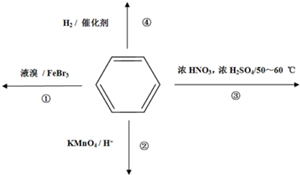
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰为淡蓝色 | |
| C. | 反应③为取代反应,有机产物是一种烃的衍生物 | |
| D. | 反应④中1 mol苯最多与6 mol H2发生加成反应 |
| A. | 单位时间生成n mol A2同时生成n mol AB | |
| B. | 容器内总压不随时间变化 | |
| C. | 单位时间生成2n mol AB同时生成n mol B2 | |
| D. | 混合气体的平均相对分子质量不随时间变化 |
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,KW减小 | |
| B. | 将水加热,Kw 增大,pH不变 | |
| C. | 向水中加入少量金属Na,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw 均不变 |

 .
.