题目内容
7.下列化合物的核磁共振氢谱中出现四组峰的是( )| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
分析 根据核磁共振氢谱中出现几组峰说明有机物中含有几种类型的氢原子,根据等效氢的判断方法来回答.
解答 解:A:2,2,3,3--四甲基丁烷的结构简式为:C(CH3)3C(CH3)3,分子中存在1种不同的H,所以核磁共振氢谱有1组峰,故A错误;
B:2,3,4 三甲基戊烷的结构简式为:CH(CH3)2CHCH3CH(CH3)2,分子中存在4种不同的H,所以核磁共振氢谱有4组峰,故B正确;
C:3,3,4,4 四甲基己烷的结构简式为:CH3CH2C(CH3)2C(CH3)2CH2CH3,分子中存在3种不同的H,所以核磁共振氢谱有3组峰,故C错误;
D:2,5 二甲基己烷的结构简式为:CH(CH3)2CH2CH2CH(CH3)2,分子中存在3种不同的H,所以核磁共振氢谱有3组峰,故D错误;
故选B.
点评 本题考查有机物中等效氢原子的判断,注意根据名称写出结构简式,难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
17. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2D?3B+4C | |
| B. | 反应进行到1s时,v(A)=v(B) | |
| C. | 反应进行到5s时,v(A)=v(B)=v(C)=v(D) | |
| D. | 反应进行到5s时,B的平均反应速率为0.06mol/(L•s) |
18. 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:H2S+2OH-=S 2-+2H2O.硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:S 2-+H2O?HS-+OH-.己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=12.(结果取整数)
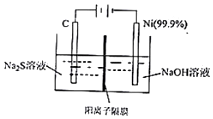
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节.实验装置如图:
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,当反应转移nmole-时,产生标准状况下的气休体积为11.2 n L.
(3)H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
①COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42KJ/mol
已知断裂1mol气态分子中的化学键所需能量如表所示.
计算表中x=1074.
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大.平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为5%,反应②的平衡常数为0.30(保留两位有效数字).
 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:H2S+2OH-=S 2-+2H2O.硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:S 2-+H2O?HS-+OH-.己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=12.(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节.实验装置如图:
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,当反应转移nmole-时,产生标准状况下的气休体积为11.2 n L.
(3)H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
①COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42KJ/mol
已知断裂1mol气态分子中的化学键所需能量如表所示.
| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大.平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为5%,反应②的平衡常数为0.30(保留两位有效数字).
15.某电池总反应为 2Fe3++Cu═2Fe2++Cu2+,不能实现该反应的原电池是( )
| A. | 电极材料 Fe、Cu,电解质溶液 FeCl3 溶液 | |
| B. | 电极材料石墨、Cu,电解质溶液 Fe2(SO4)3溶液 | |
| C. | 电极材料 Pt、Cu,电解质溶液 FeCl3溶液 | |
| D. | 电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3溶液 |
2.下列关于有机化合物的说法正确的是( )
| A. | 甲烷和乙烯都可以使溴水褪色 | |
| B. | 乙醇和乙酸都存在碳氧双键 | |
| C. | 高锰酸钾酸性溶液不可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
12.己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述不正确的是( )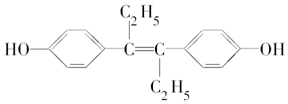

| A. | 可以使溴水褪色 | |
| B. | 该物质能发生氧化反应 | |
| C. | 1 mol该有机物可以与5 mol Br2发生反应 | |
| D. | 可与NaOH和NaHCO3溶液发生反应 |
19.用下图所示实验装置进行相应实验,能达到实验目的是( )
| A. | .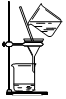 装置可用于除去乙醇中的溴苯 | |
| B. | .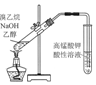 用图所示装置检验溴乙烷与NaOH醇溶液共热产生的C2H4 | |
| C. | .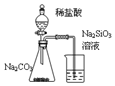 装置可证明非金属性Cl>C>Si | |
| D. | 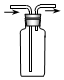 装置可用于收集O2 |
7.下列比较或归纳一定正确的是( )
| A. | 离子半径:阴离子>阳离子 | B. | 酸性:HClO4>H2SO4 | ||
| C. | 熔沸点:共价化合物>离子化合物 | D. | 稳定性:PH3>NH3 |