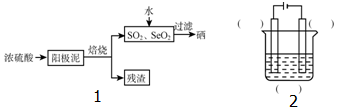
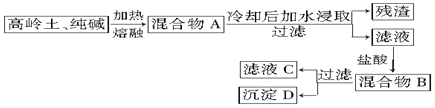
题目内容
7.下列比较或归纳一定正确的是( )| A. | 离子半径:阴离子>阳离子 | B. | 酸性:HClO4>H2SO4 | ||
| C. | 熔沸点:共价化合物>离子化合物 | D. | 稳定性:PH3>NH3 |
分析 A.离子半径大小取决于电子层数及核外电子总数;
B.非金属性越强,最高价含氧酸的酸性越强;
C.共价化合物形成的晶体有分子晶体和原子晶体,原子晶体的熔沸点较高,而分子晶体的熔沸点较小;
D.非金属性越强,对应氢化物的稳定性越强.
解答 解:A.阴离子的离子半径不一定大于阳离子,如钾离子的离子半径大于氟离子,故A错误;
B.非金属性Cl>S,则最高价氧化物对应水合物的酸性:HClO4>H2SO4,故B正确;
C.共价化合物的熔沸点不一定大于离子化合物,如二氧化硅为共价化合物,二氧化硅晶体的熔沸点大于离子化合物氯化钠,故C错误;
D.非金属性P<N,则氢化物稳定性:PH3<NH3,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
7.下列化合物的核磁共振氢谱中出现四组峰的是( )
| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
15.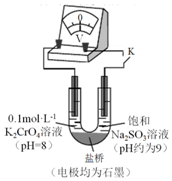 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:SO32-+H2O?HSO3-+OH-.
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
为了说明产生上述现象的原因,补充实验:
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
2.下列说法或实验操作不正确的是( )
| A. | 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 | |
| D. | 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 |
12.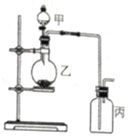 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NO2 | 浓硝酸 | 铜片 | 水 |
| B | 制取并验证SO2具有漂白性 | 70%硫酸 | 亚硫酸钠 | 品红溶液 |
| C | 制取并验证氯气没有漂白性 | 浓盐酸 | 二氧化锰 | 干燥的红布条 |
| D | 比较HCl、H2CO3和H2SiO3酸性的强弱 | 盐酸 | 大理石 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.有机物A是某种药物的中间体,其结构简式为: 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )
 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )| A. | A的分子式为C16H1403 | |
| B. | A可使酸性KMnO4溶液褪色和溴水褪色 | |
| C. | A苯环上的一氯代物同分异构体有2种 | |
| D. | A既可发生氧化反应和加成反应,又可以发生取代反应 |
1.我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶).诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%.下列推测不合理的是( )
| A. | 青蒿素在水中的溶解度很小 | B. | 青蒿素含有亲脂的官能团 | ||
| C. | 在低温下提取青蒿素,效果会更好 | D. | 乙二醇提取青蒿素的能力强于乙醚 |