题目内容
1.在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g),下列有关说法正确的是( )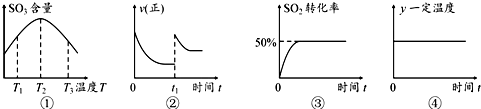
| A. | 由图①可知:该反应的△H>0 | |
| B. | 在图②中的t1时充入少量氩气,容器内压强增大,平衡右移 | |
| C. | 图③所示条件下,平衡常数为2 | |
| D. | 图④中的y可以表示平衡常数或密度 |
分析 A.图象分析可知温度为T2前三氧化硫含量增大,T2温度后三氧化硫含量减小,说明T2前反应未达到平衡状态,T2是达到平衡状态,温度升高平衡逆向进行;
B.恒容容器中充入少量氩气,容器内压强增大分压不变,平衡不变;
C.平衡时二氧化硫转化率50%,结合化学反应三行计算平衡浓度,平衡浓度K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
D.反应平衡常数随温度变化,温度不变平衡常数不变,反应前后气体质量和体积不变,密度始终不变.
解答 解:A.图象分析可知温度为T2前三氧化硫含量增大,T2温度后三氧化硫含量减小,说明T2前反应未达到平衡状态,T2是达到平衡状态,温度升高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,故A错误;
B.恒容容器中充入少量氩气,容器内压强增大分压不变,平衡不变,平衡不发生移动,故B错误;
C.平衡时二氧化硫转化率50%,结合化学反应三行计算平衡浓度,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.5
平衡浓度K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.{5}^{2}}{0.{5}^{2}×0.25}$=4,故C错误;
D.反应平衡常数随温度变化,温度不变平衡常数不变,反应前后气体质量和体积不变,密度始终不变,图象变化符合,故D正确;
故选D.
点评 本题考查了图象分析判断、影响化学平衡、平衡常数的因素分析、平衡常数计算,掌握基础是解题关键,题目难度中等.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案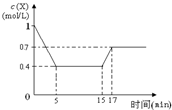 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
| A. | 碳酸氢钠溶液中加入稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| B. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | NH3 | B. | CCl4 | C. | H3O+ | D. | CH2O |
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ |
(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡油与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃M生成.0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.
①烃M的分子式为C6H12.
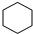
②烃N是烃M的一种同分异构体,其结构中含有4个甲基,则烃N的结构简式为
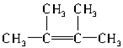 .
.③烃N中一定处于同一平面的碳原子数为6.
④写出烃N发生自身加聚反应的化学方程式
 .
. 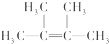 ;
;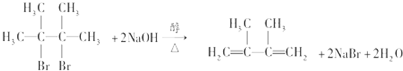 ;
; .
.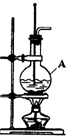 在实验室制取乙烯的装置图(如图)中,
在实验室制取乙烯的装置图(如图)中,