题目内容
13.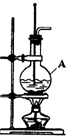 在实验室制取乙烯的装置图(如图)中,
在实验室制取乙烯的装置图(如图)中,①仪器A的名称是圆底烧瓶;A中加入的两种试剂是乙醇和浓硫酸;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水法.
②将反应产生的乙烯通入酸性高锰酸钾溶液中,观察到的现象是酸性高锰酸钾溶液褪色;
将反应产生的乙烯通入溴的四氯化碳溶液中,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br
③反应进行一段时间后,A中混合液常变黑,并伴有刺激性气味的气体产生,该气体是SO2,若要验证有该气体生成,应将生成的气体通过品红溶液溶液,若要除去该气体应将生成的气体通过NaOH溶液.
分析 ①仪器A为圆底烧瓶;制取乙烯的试剂是乙醇和浓硫酸;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2↑+H2O;乙烯不溶于水,用排水法收集;
②乙烯含碳碳双键,能使酸性高锰酸钾褪色,能与溴发生加成反应;
③浓硫酸具有强氧化性,使有机物炭化,同时产生二氧化硫,二氧化硫用品红验证,用碱液吸收.
解答 解:①仪器A为圆底烧瓶;制取乙烯的试剂是乙醇和浓硫酸;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2↑+H2O;乙烯不溶于水,用排水法收集,
故答案为:圆底烧瓶;乙醇和浓硫酸;CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2↑+H2O;排水法;
②乙烯含碳碳双键,能使酸性高锰酸钾褪色,能与溴发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:酸性高锰酸钾溶液褪色;CH2=CH2+Br2→CH2BrCH2Br;
③浓硫酸具有强氧化性,使有机物炭化,同时产生二氧化硫,二氧化硫能使品红褪色,用品红验证,二氧化硫是酸性氧化物,用碱液吸收,
故答案为:SO2;品红溶液;NaOH.
点评 本题考查了乙烯的制备、性质,明确制备原理和乙烯结构特点是解题关键,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
1.在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g),下列有关说法正确的是( )
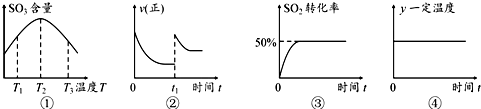

| A. | 由图①可知:该反应的△H>0 | |
| B. | 在图②中的t1时充入少量氩气,容器内压强增大,平衡右移 | |
| C. | 图③所示条件下,平衡常数为2 | |
| D. | 图④中的y可以表示平衡常数或密度 |
8.下列关于苯的说法正确的是( )
| A. | 苯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯分子具有平面正六边形结构,12个原子在同一平面上,对位上的4个原子在一条直线上 | |
| C. | 苯能使溴水褪色,是发生了取代反应 | |
| D. | 苯不含有碳碳双键故不能发生加成反应 |
18.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | H+、Fe3+、I-、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | Na+、K+、HCO3-、OH- | D. | K+、NH4+、OH-、SO42- |
5.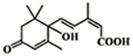 大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
 大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
2.常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaClO).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A. | 氯气的体积为1.12 L | |
| B. | 原烧碱溶液中含溶质离子0.2NA个 | |
| C. | 所得溶液中含OH-的数目为1×10-5NA | |
| D. | 所得溶液中ClO-的数目为0.05NA |
3.O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |

 .
. .
. .
. .
.