题目内容
6.下列分子中,各原子均处于同一平面上的是( )| A. | NH3 | B. | CCl4 | C. | H3O+ | D. | CH2O |
分析 A.氨气为三角锥型结构,分子中所有原子不共平面;
B.四氯化碳为正四面体结构,分子中所有原子不可能共平面;
C.水合氢离子的中心O原子采取sp3杂化,为三角锥型结构;
D.甲醛中C原子为sp2杂化,其构型为平面三角形.
解答 解:A.NH3中,氮原子采用为sp3杂化,存在一个未成对电子,所以氨气为三角锥型结构,各原子不可能处于同一平面上,故A错误;
B.四氯化碳与甲烷结构相似,为正四面体结构,分子中的所有原子不可能处于同一平面上,故B错误;
C.H3O+中O原子价层电子对个数=3+$\frac{6-2×1-2}{2}$=4,采用sp3杂化,含有3个共价单键和一个孤电子对,所以H3O+的离子立体结构为三角锥型,所有原子处于不处于同一平面上,故C错误;
D.CH2O为甲醛,中心原子碳原子采取sp2杂化,甲醛平面三角形结构,所有原子共平面,故D正确;
故选D.
点评 本题考查了常见分子或离子的构型,题目难度不大,注意掌握常见有机物结构,如甲烷为正四面体结构,乙烯和苯为平面结构,乙炔为直线型结构,能够根据简单有机物分子结构判断稍复杂有机物分子的空间结构,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.下列说法中,正确的是( )
| A. | 铝是一种既可以与强酸反应又可以与强碱反应的金属 | |
| B. | 氧化铝按组成划分属于金属氧化物,按性质划分属于碱性氧化物 | |
| C. | 氢氧化铝具有较高的熔点和沸点,常用于制造耐火材料 | |
| D. | 铝是地壳中含量最多的元素,铝土矿是铝元素在地壳中的主要存在形式之一 |
17.与27.0克H2O含有相同中子数的D2O质量为( )
| A. | 13.2g | B. | 20.1g | C. | 24.0g | D. | 30.0g |
1.在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g),下列有关说法正确的是( )
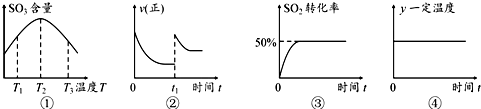

| A. | 由图①可知:该反应的△H>0 | |
| B. | 在图②中的t1时充入少量氩气,容器内压强增大,平衡右移 | |
| C. | 图③所示条件下,平衡常数为2 | |
| D. | 图④中的y可以表示平衡常数或密度 |
11.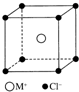 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )| A. | 6个 | B. | 8个 | C. | 12个 | D. | 16个 |
18.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | H+、Fe3+、I-、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | Na+、K+、HCO3-、OH- | D. | K+、NH4+、OH-、SO42- |
16.有关糖类叙述正确的是( )
| A. | 糖类是有甜的有机物 | |
| B. | 糖类物质又叫碳水化合物,因此所有的糖类均可用通式Cn(H2O)m来表示 | |
| C. | 糖类物质和碳水化合物没有实质的联系 | |
| D. | 糖类可以分为单糖和多糖 |

 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.