题目内容
14.电石中的碳化钙和水能完全反应:CaC2+2H2O═C2H2↑+Ca(OH)2,使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的含量.(1)若实验产生的气体有难闻的臭鸡蛋气味,这是因为含有H2S杂质.检验此杂质的反应为H2S+CuSO4=CuS↓+H2SO4
(2)若实验时称取电石1.60g,测量排出水的体积后,折算成标准状况下乙炔的体积为448mL,此电石中碳化钙的质量分数是80%.
分析 (1)乙炔中含有硫化氢气体;可以用硫酸铜溶液检验;
(2)计算乙炔的物质的量,根据方程式计算碳化钙物质的量,再根据m=nM计算碳化钙的质量,进而计算电石中碳化钙的质量分数.
解答 解:(1)若实验产生的气体有难闻的臭鸡蛋气味,这是因为含有H2S杂质,可以用硫酸铜溶液检验,反应方程式为:H2S+CuSO4=CuS↓+H2SO4,
故答案为:H2S; H2S+CuSO4=CuS↓+H2SO4;
(2)生成乙炔的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,
CaC2+2H2O═C2H2↑+Ca(OH)2
0.02mol 0.02mol
故碳化钙的质量为0.02mol×64g/mol=1.28g,
故此电石中碳化钙的质量分数是$\frac{1.28g}{1.6g}$×100%=80%,
故答案为:80.
点评 本题考查化学方程式计算、硫化氢的性质与检验,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
4.下列物质的水溶液能导电,但该物质属于非电解质的是( )
| A. | CuSO4 | B. | CO2 | C. | HCl | D. | CH3CH2OH |
5.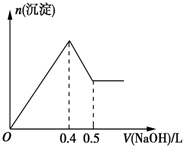 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 6:1 | B. | 2:3 | C. | 1:3 | D. | 3:1 |
9.下列关于乙烯和乙烷的说法中,错误的是( )
| A. | 乙烯是不饱和烃,乙烷是饱和烃 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能 | |
| C. | 乙烯分子中存在碳碳双键,乙烷分子中存在碳碳单键,因此乙烯比乙烷稳定 | |
| D. | 乙烯分子为平面形结构,乙烷分子为立体结构 |
19.下列操作中正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 浓硫酸沾在皮肤上时应用大量水冲洗,再涂上3%~5%的NaOH溶液 | |
| C. | 实验室进行蒸馏操作时若忘加了沸石,应停止反应冷却至室温后再加入 | |
| D. | 配制硫酸溶液时,可先在量筒中加一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
4.下列大小比较正确的是( )
| A. | 酸性:HClO>H2SO4>H2CO3; 非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF | |
| D. | 离子半径:Na+>Mg2+>Al3+>Cl-; 原子半径:Na>Mg>Al>Cl |
 ; N2结构式:N≡N.
; N2结构式:N≡N.
 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.