题目内容
4.下列大小比较正确的是( )| A. | 酸性:HClO>H2SO4>H2CO3; 非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF | |
| D. | 离子半径:Na+>Mg2+>Al3+>Cl-; 原子半径:Na>Mg>Al>Cl |
分析 A.非金属性越强,最高价含氧酸的酸性越强;
B.金属性越强,最高价氧化物的水化物碱性越强;
C.非金属性越强,对应氢化物越稳定、还原性越弱;
D.同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小,电子层越多半径越大.
解答 解:A.非金属性Cl>S>C,酸性:HClO4>H2SO4>H2CO3,而HClO的酸性比碳酸弱,故A错误;
B.金属性:Cs>K>Na>Mg,则碱性:CsOH>KOH>NaOH>Mg(OH)2,故B错误;
C.非金属性F>O>N>C,则稳定性:HF>H2O>NH3>CH4,还原性:CH4>NH3>H2O>HF,故C正确;
D.同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小,电子层越多半径越大,则离子半径:Cl->Na+>Mg2+>Al3+,原子半径:Na>Mg>Al>Cl,故D错误;
故选C.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列各组烃的混合物,只要总质量一定,无论它们按何种比例混合,完全燃烧后生成的CO2和H2O都是恒量的是( )
| A. | C2H2、C2H4 | B. | C2H4、C3H6 | C. | C2H6、C3H8 | D. | CH4、C2H2 |
12.下列有关物质的分类或归类正确的是( )
①混合物:水玻璃、水银
②化合物:氯化钙、烧碱、HD
③电解质:冰醋酸、硫酸钡
④同素异形体:H2O H2O2
⑤同位素:12C、13C、14C
⑥同分异构体:
①混合物:水玻璃、水银
②化合物:氯化钙、烧碱、HD
③电解质:冰醋酸、硫酸钡
④同素异形体:H2O H2O2
⑤同位素:12C、13C、14C
⑥同分异构体:

| A. | ①③④ | B. | ③⑤⑥ | C. | ①②③ | D. | ②⑥ |
19.某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
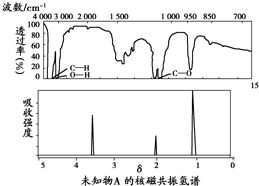

| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 由核磁共振氢谱无法得知其分子中的氢原子总数 |
9.已知:2H2(g)+O2(g)═2H2O(g)1molH2完全燃烧放出热量为241.8KJ有关键能数据如表:
则H-H键键能为( )
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 872KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
13.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | Cl2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | NO2 | SO2 | BaCl2 |
| A. | ①②③④⑤ | B. | 只有②③④ | C. | 只有①③④ | D. | ①②③④⑥ |
14.对于反应4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g),改变下列条件不会影响反应速率的是( )
| A. | 增大压强 | B. | 不断鼓入空气 | C. | 加入FeS2 | D. | 升高温度 |
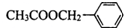 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: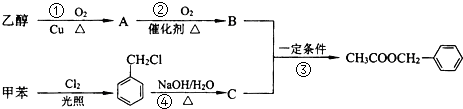
 +H2O$→_{△}^{氢氧化钠}$
+H2O$→_{△}^{氢氧化钠}$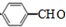 ;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式:
;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式: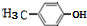
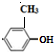 .
.