题目内容
17.下表中相关物质的信息都正确的一项是( )| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 | 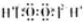 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaClO中钠离子和次氯酸根离子之间存在离子键、O-Cl原子之间存在共价键,次氯酸钠具有强氧化性而使蛋白质变性;
B.双氧水是共价化合物,只存在共价键;
C.氨气中只含共价键,氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子而使其水溶液呈溶解性,工业制取硝酸的原料是氨气;
D.碳酸氢钠属于强碱弱酸酸式盐,能和铝离子发生双水解反应而生成二氧化碳.
解答 解:A.NaClO中钠离子和次氯酸根离子之间存在离子键、O-Cl原子之间存在共价键,次氯酸钠具有强氧化性而使蛋白质变性,所以可以作消毒剂,故A正确;
B.双氧水是共价化合物,只存在共价键,其电子式为 ,故B错误;
,故B错误;
C.氨气中只含共价键,氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子而使其水溶液呈弱碱性,该现象属于化学性质,故C错误;
D.碳酸氢钠属于强碱弱酸酸式盐,能和铝离子发生双水解反应而生成二氧化碳,与其稳定性强弱无关,故D错误;
故选A.
点评 本题考查较综合,涉及化学键、电子式、物质性质及用途等知识点,明确物质组成、结构、性质和用途之间关系是解本题关键,易错选项是C,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
7. 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
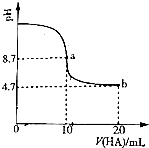
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
8.晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
③SiHCl3与过量H2在1000~1100℃反应制得纯硅可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
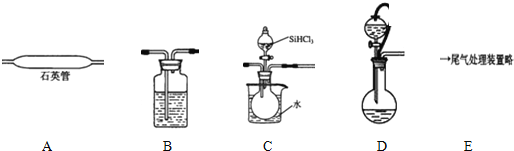
①依次连接的合理顺序为DBCAE;装置D中g管的作用是平衡压强;装置B中的试剂是浓硫酸;装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①依次连接的合理顺序为DBCAE;装置D中g管的作用是平衡压强;装置B中的试剂是浓硫酸;装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
5.下列说法中正确的是( )
| A. | 分别与滴有酚酞的NaOH溶液共热可区别煤油与植物油 | |
| B. | 煤含有苯、甲苯等,先干馏后分馏获可得苯、甲苯等芳香烃 | |
| C. | 在水电离出H+浓度为1×10-12mol/L溶液中一定大量存在Fe2+、Na+、NO3-、Cl- | |
| D. | 在NH4HSO3溶液中加入少量NaOH溶液反应的离子方程式为NH4++OH-=NH3•H2O |
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
2.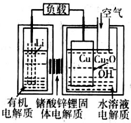 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,氧化剂为O2 |
9.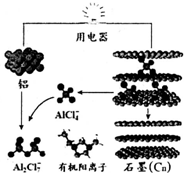 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
6.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽 | |
| D. | 乙醇、乙二醇、丙三醇的沸点依次升高 |
7.X、Y、Z、W是原子序数递增的四种短周期元素.X、Z同主族,且原子序数相差10;Y的最外层电子数是电子层数的三倍;W可与X、Z形成XW和ZW型化合物.下列说法错误的是( )
| A. | 化合物XW中含有共价键 | |
| B. | 化合物ZW中含有离子键 | |
| C. | X和Z可以形成离子化合物ZX | |
| D. | 化合物ZYX和ZYW所含有的键型不一样 |