题目内容
7.X、Y、Z、W是原子序数递增的四种短周期元素.X、Z同主族,且原子序数相差10;Y的最外层电子数是电子层数的三倍;W可与X、Z形成XW和ZW型化合物.下列说法错误的是( )| A. | 化合物XW中含有共价键 | |
| B. | 化合物ZW中含有离子键 | |
| C. | X和Z可以形成离子化合物ZX | |
| D. | 化合物ZYX和ZYW所含有的键型不一样 |
分析 短周期元素的X、Y、Z、W原子序数依次增大,X、Z同主族,且原子序数相差10,则为第IA族,所以X为H元素,Z为Na元素;Y原子最外层电子数是电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;W可与H、Na形成HW和NaW型化合物,而且W的原子序数比钠大,所以W为Cl元素,据此解答.
解答 解:短周期元素的X、Y、Z、W原子序数依次增大,X、Z同主族,且原子序数相差10,则为第IA族,所以X为H元素,Z为Na元素;Y原子最外层电子数是电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;W可与H、Na形成HW和NaW型化合物,而且W的原子序数比钠大,所以W为Cl元素,
A.X为H元素,W为Cl元素,化合物HCl中含有共价键,故A正确;
B.Z为Na元素,W为Cl元素,化合物NaCl中含有离子键,故B正确;
C.X为H元素,Z为Na元素,二者可以形成离子化合物NaH,故C正确;
D.化合物NaOH含有共价键和离子键,NaClO含有共价键和离子键,所以二者所含有的键型一样,故D错误,
故选D.
点评 本题考查结构性质位置关系应用,题目难度不大,侧重对元素周期律的考查,明确元素涉及解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
17.下表中相关物质的信息都正确的一项是( )
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 |  | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
18.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
15.在密闭容器里,2A+B?2C,其反应速率分别用vA、vB、vC表示,则( )
| A. | 2vB=3vA | B. | 3vC=2vB | C. | vB=vA | D. | vC=2vB |
19.周期表中有如图所示的元素,下列叙述正确的是( )


| A. | 47.87是丰度最高的钛原子的相对原子质量 | |
| B. | 钛原子的M层上共有10个电子 | |
| C. | 从价电子构型看,钛属于某主族元素 | |
| D. | 22为钛原子的质量数 |
8.下列说法中正确的是( )
| A. | 向MgCl2溶液中加入过量的NaOH溶液,Mg2+沉淀完全,则溶液中不含Mg2+ | |
| B. | Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小 | |
| C. | 25℃时,由于Kw(ZnS)>Kw(CuS),所以ZnS在一定条件下可转化为CuS | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
 ;Al
;Al ;O
;O ;C
;C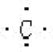 ;Cl-
;Cl- ;
; ;NaOH
;NaOH ;KBr
;KBr ;Na2S
;Na2S ;HI
;HI .
.